一 实验思路
| 步骤 | 关键内容 |
| 实验 目标 |
通过36色流式细胞术Panel,用于微量人全血(200 µL)中T/B/NK细胞的深度免疫表型分析 |
| 实验 种属 |
Human,新鲜抗凝全血(已去除血浆) |
| 关键 策略 |
对 T 细胞、B 细胞和 NK 细胞进行深度免疫表征,重点关注 T 细胞的活化、分化、效应功能、耗竭,以及共抑制 / 共刺激分子的表达 |
| 适用 场景 |
儿童/重症患者样本量有限(如疟疾研究),需最大化信息量,也可适用于分析PBMC、组织样本及其他感染性或炎症性疾病患者的样本 |
二 关键实验步骤整理
疟疾仍是一种威胁生命的疾病,2022 年全球范围内有 2.49 亿病例,超过 60 万人死亡 。尽管首批疫苗能在一定程度上预防疟疾发作和与疟疾相关的死亡,但其效果是局部且短暂的。
本文旨在用于少量血样,建立 36 色流式细胞术方案,能够在单细胞水平上对免疫细胞进行深入分析,帮助更好地理解对疟原虫感染的免疫反应。实验步骤具体如下:
1 样本准备
获取新鲜抗凝全血,去除血浆,得到实验用样本 。
2 细胞标记染色
1. 死细胞染色:使用 Live Dead 染料对样本进行染色,标记死细胞,以便后续区分活细胞与死细胞 。
2. 表面标记染色:加入针对不同表面分子(如 T 细胞、B 细胞、NK 细胞分化标记,免疫检查点、趋化因子受体等相关标记,如 CD3、CD4、CD8、CD19、CD56、CTLA - 4、PD - 1 等)的抗体,孵育后洗涤,完成细胞表面分子标记 。
3. 胞内标记染色:对样本进行固定破膜处理后,加入转录因子(如 FOXP3、T - bet 等 )、活化 / 效应分子(如 Ki - 67、Granzyme B 等 )相关胞内抗体,孵育后洗涤,实现胞内分子标记 。
3 流式细胞仪检测
采用光谱流式细胞仪检测标记后的样本信号,依据预设设门策略(如区分 NK、B、T 细胞亚群等 ),对各细胞亚群进行识别和分析,获取标记物表达水平数据 。
4 数据分析
借助数据分析软件等工具,对检测数据进行归一化和可视化处理,对比不同样本(如健康对照与疟疾患者样本 )中各细胞亚群的表型及功能差异 。
三指标选择与圈门逻辑
指标选择

△点击放大图片
圈门逻辑
△点击放大图片
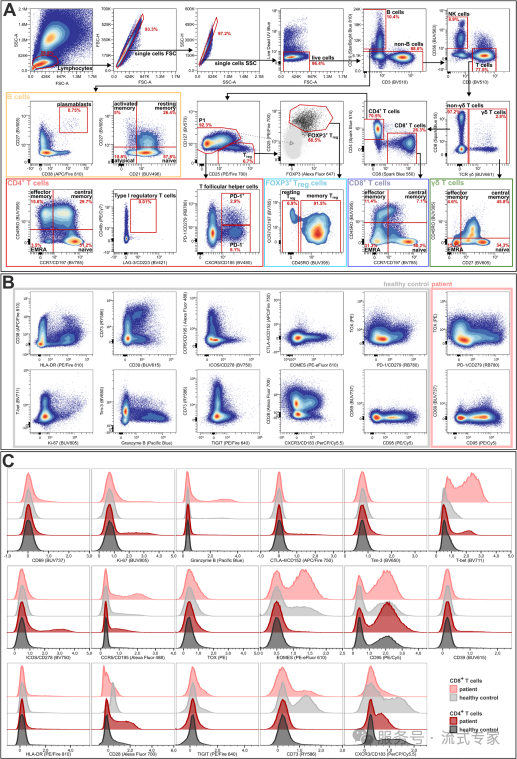
设门策略及所有标记物的表达情况
(A)该设门策略可识别 NK 细胞、B 细胞和 T 细胞。在 B 细胞区室中,可定义记忆表型并鉴定浆母细胞。T 细胞分为 CD4⁺和 CD8⁺ T 细胞以及 γδ T 细胞。在这三个区室中,均可识别记忆表型。在 CD4⁺区室中,可定义调节性 T 细胞(Treg)、1 型调节性 T 细胞(Tr1)和滤泡辅助性 T 细胞(Tfh)。在 CD4⁺CD127⁻CD25⁺群体中,借助 CD4⁺CD25⁻群体的叠加图(浅灰色)对 FOXP3⁺调节性 T 细胞进行设门。FOXP3⁺细胞的百分比仅计算为 CD4⁺CD127⁻CD25⁺群体的百分比。
(B)该组合中所有剩余标记物的点图(以所有活淋巴细胞为设门对象)显示了与设门树相同的健康对照样本(灰色框),对于在健康对照中无表达或低表达的标记物,同时展示了患者样本(浅红色框)。
(C)疟疾病人(红色)和健康对照(灰色)的相同标记物表达直方图,以 CD4⁺(深色调)和 CD8⁺ T 细胞(浅色调)为设门对象。对于(C),样本使用 fdaNorm 算法进行了归一化处理。
参考文献
OMIP-114: A 36-Color Spectral Flow Cytometry Panel for Detailed Analysis of T Cell Activation and Regulation in Small Human Blood Volumes





