“肠-靶轴“研究思路

△点击放大图片
在外界环境干预下,肠道菌群的差异组成会分泌差异代谢产物,产物进入循环系统后,随着体液至不同靶器官,随之靶器官出现不同的响应,导致疾病的发生;
01 常见的代谢物有哪些?
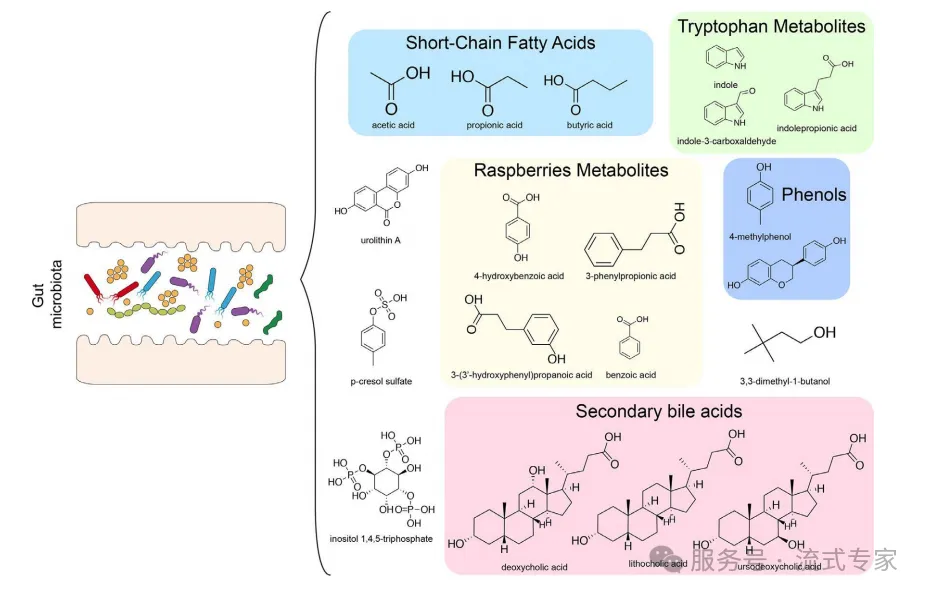
△点击放大图片
l 短链脂肪酸(SCFAs)
乙酸(Acetate)、丙酸(Propionate)、丁酸(Butyrate)
l 吲哚及其衍生物(Indole and Derivatives)
吲哚(Indole)、吲哚-3-丙酸(Indole-3-propionic acid, IPA)、吲哚-3-甲醛(Indole-3-carboxaldehyde)
l 尿石素A(Urolithin A, UA)
02 代谢物的功能和影响的免疫细胞
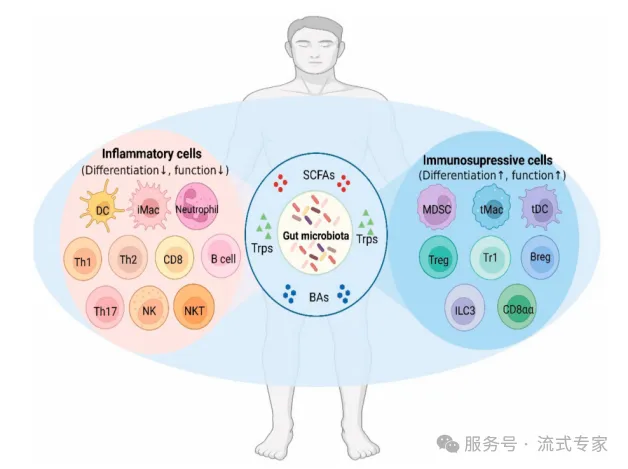
△点击放大图片
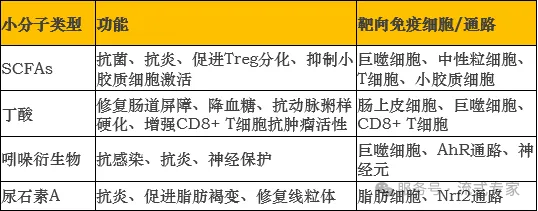
△点击放大图片
03 肠道菌群代谢物和疾病关联:
intestinal barrier
△点击放大图片
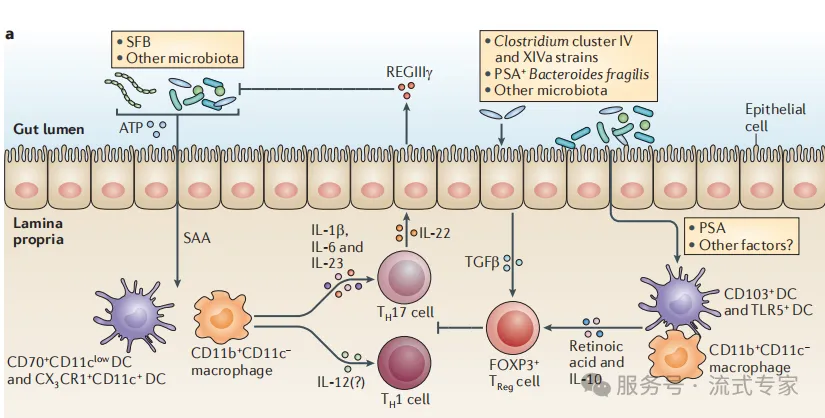
菌群促进免疫稳态
l 肠道微生物如节段丝状菌(SFB)、梭菌属(Clostridium)等
⟶ 诱导Th17、Treg等免疫细胞分化;
l 代谢物ATP、SAA等
⟶ 激活树突状细胞与巨噬细胞
⟶ 上调IL-22、IL-10等因子,维持上皮完整性
△点击放大图片
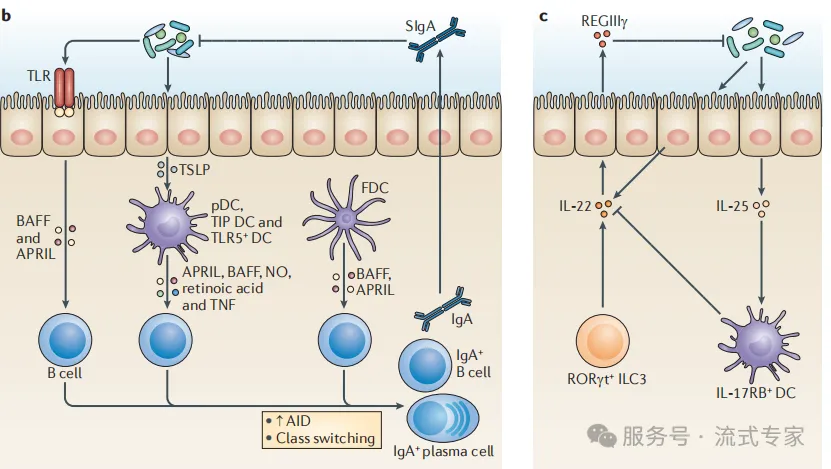
增强黏膜免疫
· 微生物通过TLR信号
⟶ 激活DC细胞,诱导B细胞转化为IgA⁺浆细胞
· 产生IgA抗体,阻止病原物穿透上皮
· REGIIIγ/IL-22等因子
⟶ 增强物理屏障与黏膜免疫防御
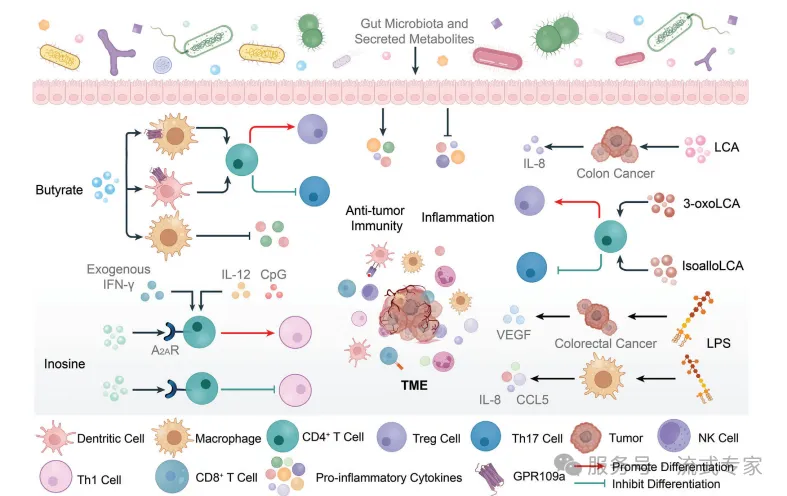
tumor progression
△点击放大图片
菌群代谢物重塑TME
丁酸盐(Butyrate):促DC激活,增强抗肿瘤免疫
次黄嘌呤(Inosine):激活CD8⁺ T细胞,提高IFN-γ应答
次级胆汁酸(LCA类):抑制Th17,减轻炎症
脂多糖(LPS):促VEGF/IL-8,助推结直肠癌进展
菌群代谢物影响免疫细胞分化与炎症,决定TME走向
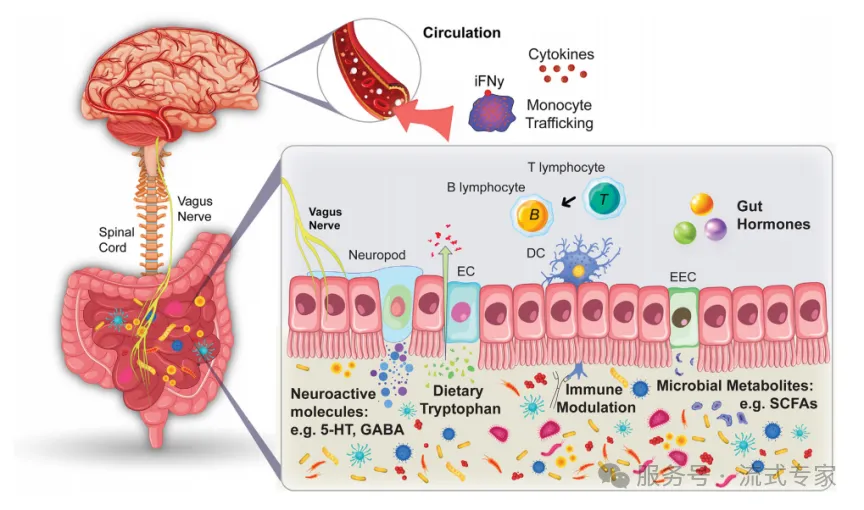
菌群如何影响大脑功能?
△点击放大图片
肠-免疫-脑轴通讯机制
· 迷走神经:连接肠道与中枢,感应菌群信号
· 神经活性分子:如5-HT、GABA,调控情绪与神经功能
· 免疫调节:菌群代谢物(如SCFAs)影响T细胞、DC活性
· 色氨酸代谢:调控神经递质合成与炎症水平
· 循环因子:细胞因子、单核细胞进入脑部参与神经炎症
菌群通过神经、免疫、代谢多通路影响大脑功能
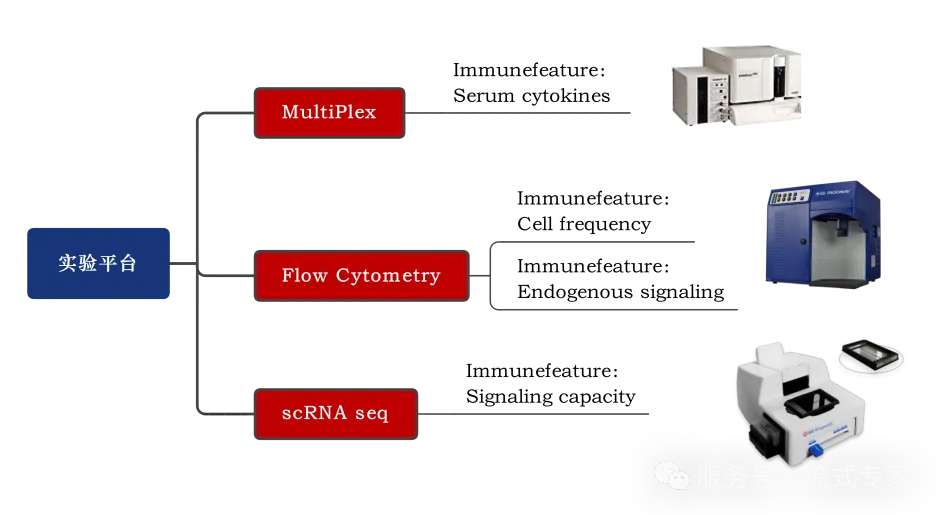
多技术平台协同,解析免疫微环境
△点击放大图片
案例:
多技术串联揭示后生元增强免疫治疗敏感性的机制
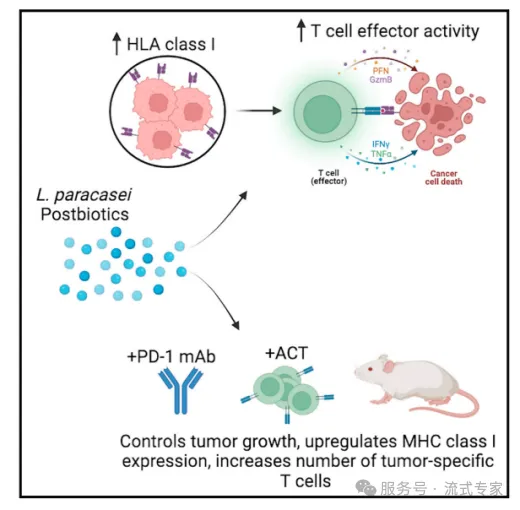
参考文献:Sensitizing cancer cells to immune checkpointinhibitors by microbiota-mediated upregulation of HLA class l
△点击放大图片
|
步骤 |
关键内容 |
|
科学问题 |
癌细胞通过下调HLA-I逃避免疫系统;后生元(postbiotics)是否能逆转此过程,提高免疫治疗(ICIs)效果? |
|
实验分组 |
体外模型:多种人源癌细胞(乳腺癌、黑色素瘤等)+ 后生元处理;体内模型:4T1(乳腺癌)和CT26(结直肠癌)小鼠模型; 处理分组:对照组 vs 后生元组 vs ICIs组 vs 联合治疗组; |
|
关键技术 |
流式、RNA-seq、代谢组学、动物实验等 |
|
实验结论 |
后生元通过MYD88-NF-κB信号诱导NLRC5上调,增强癌细胞HLA-I表达,提高抗原呈递与T细胞杀伤能力。与ICIs联合可显著抑瘤、延长生存,提供新型免疫治疗组合策略。 |
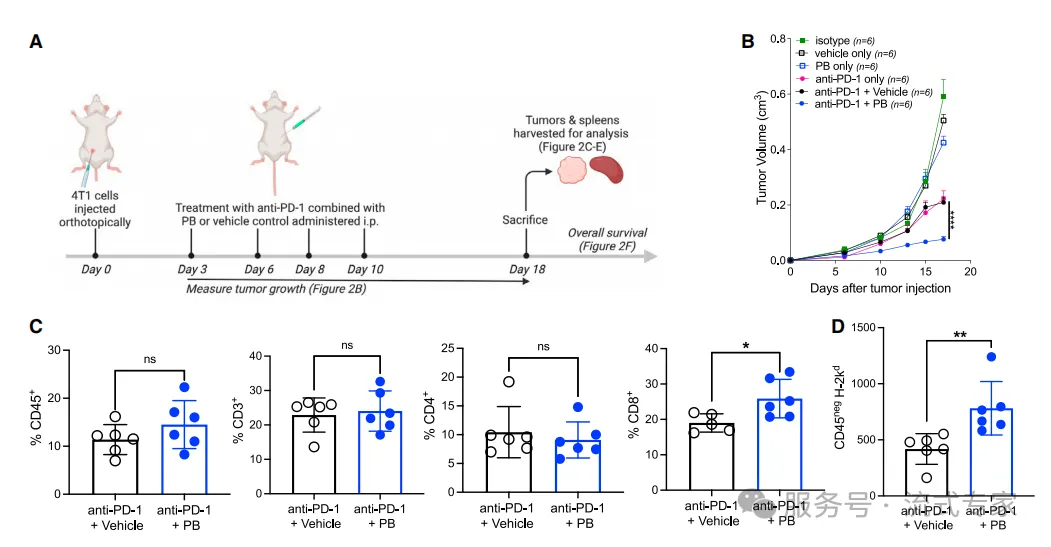
△点击放大图片

△点击放大图片
后生元+anti-PD1治疗能促进CD8+T细胞浸润并延长生存
l 小鼠模型:后生元+ICIs控制TNBC/CRC肿瘤进展(流式检测MHC I、CD8)
l 通路验证:
RNA-seq + IF:证实HLA-I/NLRC5上调
shNLRC5敲低 + 抑制剂(NF-κB/MYD88):功能丧失,机制成立
l 代谢组学:鉴定关键分子phytosphingosine,上调HLA-I并诱导NF-κB活化
实验思路总结
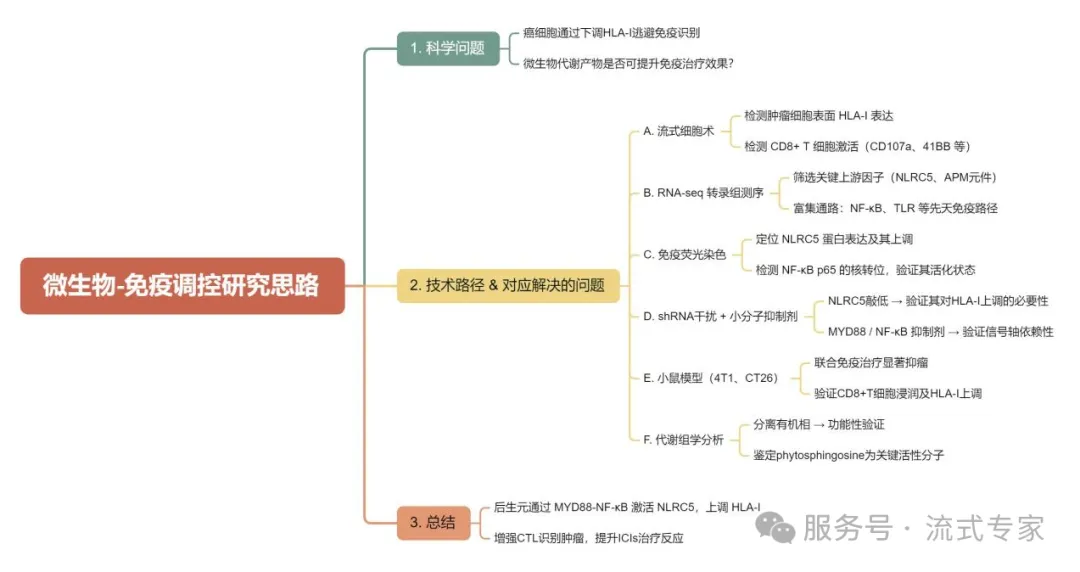
△点击放大图片
更多流式资源,可点击跳转查看
1、NK细胞分选&诱导分化
2、ADCC
3、NK相关骨架panel