视频素材来源于YouTube https://www.youtube.com/watch?v=TvDjKSuAtnU
版权归原作者所有
人类肾脏由四个祖细胞群发展而成,即肾单位祖细胞,输尿管上皮祖细胞,肾间质祖细胞和内皮祖细胞, 最多可形成200万个肾单位。
已有研究方法能将人多能干细胞(hPSC)分化为肾单位祖细胞或输尿管上皮祖细胞,分别仅形成肾单位或收集导管。
有研究表明可同时诱导所有四个祖细胞生成肾脏类器官。
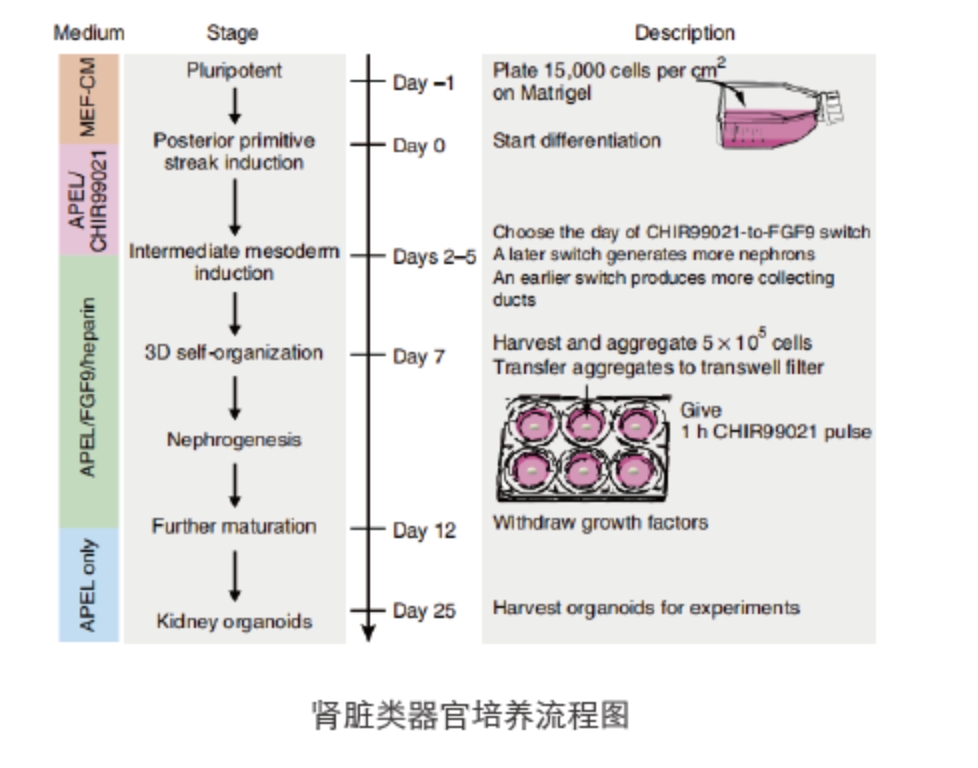
△点击放大图片
实验步骤
- 1
- 2
- 3
- 4
- 5
- 6
- 7
-
小鼠胚胎成纤维细胞(MEFs)的接种
1. 基质胶铺板,37°C的CO2培养箱中孵育1h
2. 接种MEFs细胞,在5ml MEF培养基中稀释得到3×105个细胞的细胞悬液,将细胞接种到涂有明胶的25cm2组织培养瓶中,获得 12×103/cm2个细胞的密度,然后在37°C的CO2培养箱中孵育过夜。 -
人类胚胎干细胞(hESCs)复苏
3. 在37°C水浴中复苏含1.5‒2.0×106 的hESCs,直到残留少量冰块。将细胞悬液逐滴转移至装有预热DMEM / F-12的15 ml锥形管中, 并在室温下以400g离心3min。
4. 除去上清液,将细胞重悬于5 ml添加了10 ng / ml bFGF的hESC培养基中。
5. 从装有有丝分裂灭活的MEFs的烧瓶中移出MEF培养基,并铺板上述hESCs悬浮液。将MEFs在37°C的CO2培养箱中孵育过夜。 -
培育hESCs
在MEFs滋养层培育hESCs
6. 更新培养基:5 ml的hESC培养基(每天补充10 ng / ml bFGF),持续4-5 d。【关键步骤:为获得最佳结果,培养4-5天后细胞应汇合至80-100%。如果细胞未达到融合水平,则再培育一天。】
在基质胶上培育hESC
7. 准备一个基质胶预包被的25 cm2组织培养瓶。
8. 为了将hESCs转移至基质胶上,在25 cm2组织培养瓶中的MEFs饲养层中采用3 ml DPBS洗涤hESCs两次;弃掉DPBS。
9. 向细胞中加入1 ml的TrypLE Select,并将烧瓶在37°C孵育3分钟。
10. 用移液器吸取11 ml DMEM / F-12添加至细胞,充分混合。【关键步骤:移液操作不超过两次,因为hESCs非常敏感。】
11. 在15ml试管中收集4ml的细胞悬液,以达到1:3的稀释比,并在室温下以400g离心3分钟。或者,可以选择1:2的稀释比,则细胞将在步骤13达到70-100%的融合度。
12. 弃去上清液,向细胞中加入5 ml添加了10 ng / ml bFGF的MEF条件hESC培养基。轻柔混合。
13. 从预包被基质胶的25cm2组织培养瓶中吸出含基质胶的DMEM / F-12,并接种步骤11中的细胞。将其在37°C CO2培养箱中培养2d, 每天更换补充了10 ng / ml bFGF的MEF条件hESC培养基。 -
hESCs铺板以进行分化
14. 在25cm2组织培养瓶中,用3 ml DPBS在基质胶上洗涤hESCs两次。弃掉DPBS。
15. 向细胞中加入1 ml的TrypLE Select,在37°C孵育3min。
16. 用移液器吸取10 ml DMEM /F-12添加到细胞,充分混合。
【关键步骤:移液操作不要超过两次,因为hPSCs非常敏感。】
17. 将细胞悬浮液收集在15ml试管中。使用血细胞计数器计数细胞数。
18. 计算细胞悬浮液体积以获得375,000个细胞。
19. 将细胞转移至的15ml试管。室温条件下400g离心3min。
20. 除去上清液,将细胞重悬于4 ml补充有10 ng / ml bFGF的MEF条件hESC培养基中。将细胞接种到预包装基质胶的25cm2组织培养瓶中,获得15×103/cm2个细胞的密度。将其在37°C的CO2培养箱中孵育过夜。 -
诱导中胚层
21. 从25cm2的组织培养瓶中吸除MEF条件hESC培养基。
【关键步骤:细胞在这一天应达到40-50%的汇合度。如果尚未达到,请在步骤 17中调整铺板的细胞数。】
22. 向hESCs中加入4 ml含8 μM CHIR99021的APEL培养基。
23. 将细胞在37°C的CO2培养箱中培养2-5 d,每2 d更换含8 μM CHIR99021的APEL培养基。
【关键步骤:CHIR99021的给药时间决定了类器官中获取导管与肾单位的比率。较短的CHIR99021给药时间将诱导更多的前中胚层,而较长的CHIR99021给药时间将诱导更多的后中胚层。为了获得两个隔室,建议CHIR99021的给药时间为施用3-4 d。】
24. 在CHIR99021给药之后,将培养基更改为8 ml的APEL培养基,其中补充200 ng/ml的FGF9和1μg/ml的肝素。
【关键步骤:较低的 FGF9浓度和/或体积会导致更低的中间中胚层诱导率。】
25. 在37°C的CO2培养箱中培养细胞,每2天更换培养基直到分化的第7天,将步骤24视为第0天,包含CHIR99021和FGF9的添加。 -
形成聚集体以培育肾脏类器官
26. 吸出培养基并用3 ml DPBS洗涤细胞。弃掉DPBS。
27. 向细胞中加入1 ml胰蛋白酶EDTA(0.05%),并在37°C下孵育3分钟。
28. 用显微镜观察,以确保2分钟后所有细胞都已不再贴壁。如果细胞仍然贴壁,请用胰蛋白酶轻轻吹打细胞,然后再放回培养箱中孵育1分钟。
29. 将细胞悬浮液转移到含有9 ml MEF的15ml离心管中,以中和胰蛋白酶。在室温条件下400g离心3分钟。
30. 吸出上清液,并用3 ml APEL培养基重悬细胞。
31. 取出10 μl细胞悬液,采用血细胞计数器进行细胞计数。
32. 每个类器官单元约有5×105个细胞。将所需量的细胞悬液添加到1.5ml离心管中。在室温下400g离心2分钟,以获得细胞沉淀。
33. 在六孔Transwell细胞培养板中加入1.2 ml含5 μM CHIR99021的APEL。Transwell过滤器附着在介质表面。
34. 使用P1000或P200收获肾脏类器官。
35. 小心地将沉淀物放置在六孔Transwell过滤器上,并尽量减少APEL培养基残留。在37°C孵育沉淀1小时。
36. 孵育1小时后,取出含有5 μM CHIR99021的APEL培养基,然后加入1.2 ml补充有200ng/ml FGF9和1μ /ml肝素的APEL培养基。
37. 培养沉淀5天,每2天更新FGF9和含肝素的APEL培养基。
38. 5天后,将培养基更换为不含FGF9含肝素的APEL培养基。
39. 再将类器官培养6至13天,每2天更新一次APEL培养基。 -
参考文献
P.S.以上实验步骤均来自文献总结,仅供参考
1. Lancaster, M.A. & Knoblich, J.A. Organogenesis in a dish: modeling development and disease using organoid technologies. Science 345, 1247125 (2014).
2. Takasato, M. et al. Kidney organoids from human iPS cells contain multiple lineages and model human nephrogenesis. Nature 526, 564‒568 (2015).
3. Takasato, M., Er, P.X., Chiu, H.S. & Little, M.H. Generation of kidney organoids from human pluripotent stem cells. Protoc. Exch. doi:10.1038/protex.2015.087 (2015).
4. Saxen, L. Organogenesis of the Kidney (Cambridge University Press, 1987).
5. Takasato, M. et al. Directing human embryonic stem cell differentiation towards a renal lineage generates a self-organizing kidney. Nat. Cell Biol. 16, 118‒126 (2014).
6. Takasato, M., Maier, B. & Little, M.H. Recreating kidney progenitors from pluripotent cells. Pediatr. Nephrol. 29, 543‒552 (2014).


