视频素材来源于YouTube https://www.youtube.com/watch?v=2CnkYtl99Cc
版权归原作者所有
小肠类器官培养首先要获得肠干细胞,而利用LGR5做标志物可分离得到小肠干细胞。
在这里,我们将分享Hans Clevers实验室长期培养肠类器官的实验流程。
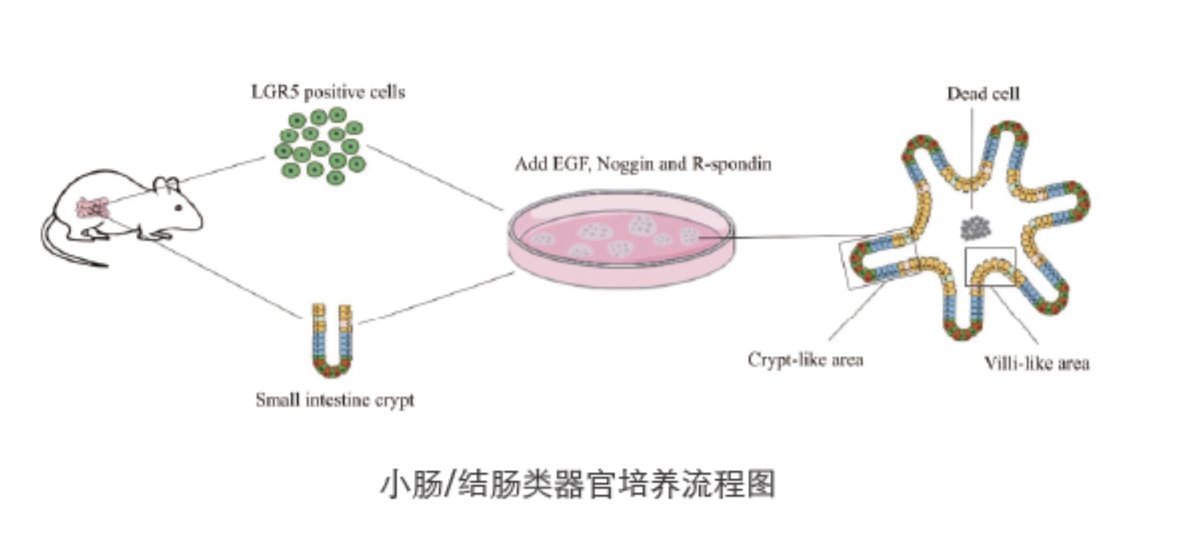
△点击放大图片
实验步骤
- 1
- 2
- 3
- 4
- 5
-
组织标本的分离
1. 取患者的部分回肠及结肠组织约3-5cm长度,放入预冷的PBS中;
2. 肠段从中间剪开,固定于泡沫板上,用镊子和眼科剪将粘膜下层和肌层分离开。用PBS清洗4-5次,用载玻片将小肠的绒毛刮去后,用剪刀将肠管剪成4-5段,放入盛有PBS的50 ml离心管中,置于冰上。 -
人小肠类器官的培养
以24孔板为例,以重悬隐窝基质胶混合物50μl来接板,接板后加入500μl隐窝培养基
3. 将50ml离心管转移至生物安全柜中,用含有双抗的PBS清洗3-4次,将肠粘膜转移至25ml 2 mmol/L EDTA溶液中,后转移至4℃冰箱中,小肠消化30min,结肠消化1h;
4. 将消化好的小肠粘膜转移至50ml离心管中,加25ml含双抗的PBS,用力地摇晃50下,悬浮液用70μm的细胞过滤筛过滤(去除绒毛和杂质)。1000 r/min室温离心5min;
5. 弃上清,用2ml的DMEM/F12重悬沉淀,显微镜下观察计数,隐窝的数量8-10个/μl最好;
6. 加适当体积的悬液加入到1.5ml的离心管中,1000 r/min 室温离心5min;
7. 用事先在冰上预冷的基质胶混合物(基质胶与培养基为2:1配比)重悬沉淀;
8. 接板,将24孔板事先在培养箱中预热,然后每孔接50μl的重悬液;
9. 将预热隐窝培养基加500μl/孔。37℃培养5-14天 -
类器官的传代
10. 在成熟类器官的24孔板中,每孔加入约500ul的DMEM/F12,用中枪头将孔中的基质胶小心的刮出,收集每个孔中的悬液置于15ml离心管中;
11. 将可以传代的隐窝冰上放置5-10min;
12. 用大枪头吹打将基质胶打碎,然后调制700ul量程,吹打30下左右,此过程避免产生气泡。可取适量的悬液观察,直至看不到大块的类器官团块为止;
13. 其后步骤同【人小肠类器官培养步骤中4-7】⸺传代中,在刮出培养板基质胶以及在枪头吹打中尽量避免隐窝损失。若隐窝状态良好可进行1:3传代,若状态较差可进行1:1传代。 -
类器官的冻存
14. 将需要冻存的类器官冰上放置5-10min;
15. 收集类器官,同【类器官传代步骤中的3】;
16. 离心后弃上清,用800ul的冻存培养液重悬,将重悬液移至冻存管中,放入冻存盒中于-80°C冰箱中保存24h,如需长久保存,则24h后转移至液氮罐保存。 -
参考文献
P.S.以上实验步骤均来自文献总结,仅供参考
1. Montesano R, Schaller G, Orci L. Induction of epithelial tubular morphogenesis in vitro by fibroblast-derived soluble factors. Cell ; 66(4): 697-711
2. Sato T,Vries RG,Snippert HJ,et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche[ J].Nature,2009,459 ( 7244) : 262-265.
3. Mahe MM,Aihara E,Schumacher MA,et al. Establishment of Gastrointestinal Epithelial Organoids[J].Curr Protoc Mouse Biol,2013,3 ( 4) : 217-240.
4. Perreault N. & Jean-Francois, B. Use of the dissociating enzyme thermolysin to generate viable human normal intestinal epithelial cell cultures. Exp. Cell Res. 224,354–364.
5. Evans, G. S., Flint, N., Somers, A. S., Eyden, B. & Potten, C. S. The development of a method for the preparation of rat intestinal epithelial cell primary cultures. J. Cell Sci. 101, 219–231.
6. Whitehead, R. H., Demmler, K., Rockman, S. P. &Watson, N. K. Clonogenic growth of epithelial cells from normal colonic mucosa from both mice and humans. Gastroenterology 117, 858–865.


