分选步骤
- 1
- 2
- 3
- 4
-
单核细胞样本制备(分选前处理)
1、PBMC重悬
- 离心获取PBMC沉淀(300 × g,10 min,RT)
- 按比例重悬:每10⁸细胞用300 μl MACS缓冲液(含0.5% FCS + 2 mM EDTA)
- 示例:3×10⁹细胞 → 9 ml缓冲液
2、阻断与标记
- 加入 FcR阻断剂(100 μl/10⁸细胞)
- 加入 DC分选抗体cocktail(100 μl/10⁸细胞)
- 关键控制:4℃孵育10分钟(避免非特异性结合)
-
MACS分选柱预处理
1、预冷处理
- 提前将LS分选柱和磁铁适配器置于4℃冷却
2、柱子活化
- 将LS柱插入MACS磁铁
- 用3 ml预冷MACS缓冲液冲洗柱子(弃去流出液)
- 柱子规格:最大载量2×10⁹细胞(可分离10⁷标记细胞)
-
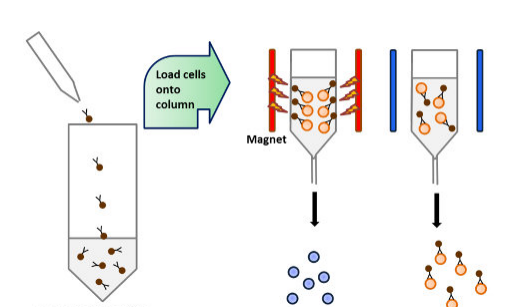
细胞过柱与DC捕获
1、上样准备
- 标记后细胞用PBS洗涤(300 × g,10 min)
- 重悬浓度:500 μl MACS缓冲液/10⁸细胞
2、分级过柱
步骤 操作 目的 首次过柱 细胞悬液加入活化柱 捕获非DC细胞 二次富集 收集流穿液→重过原柱 提高DC纯度 最终洗涤 3 ml缓冲液洗柱×2次 回收残留DC DC位置:流穿液即为目标DC群体 3、细胞收集
- 合并所有流穿液
- 离心沉淀(300 × g,10 min)
- 重悬计数用于下游实验
△点击放大图片
-
分选质量验证(流式表型分析)
1、抗体染色
- 取10⁵细胞,400 × g离心5 min
- 阻断:加1 μl正常鼠血清(RT,10 min)
- 四色抗体组合:
- 阳性标志:HLA-DR-PE(验证DC)
- 阴性标志:
- CD14-FITC(排除单核细胞)
- CD19-FITC(排除B细胞)
- TCRαβ-FITC(排除T细胞)
2、流式设置
- 避光染色(RT,20 min)
- 洗涤:10× PBS体积(400 × g,5 min)
- 重悬:500 μl PBS上机
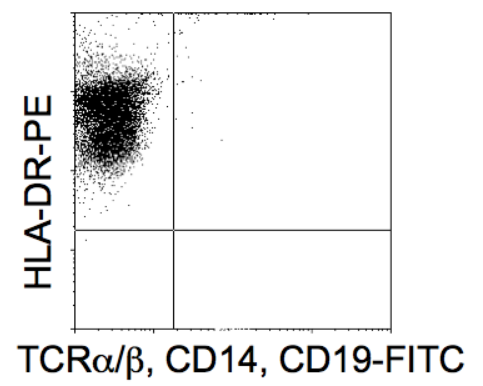
3、典型DC表型
△点击放大图片
✅ HLA-DRʰⁱᵍʰ
❌ CD14⁻/CD19⁻/TCRαβ⁻
附加标志:CD1a⁺/CD86⁺/CD83ˡᵒʷ
4、关键操作要点
风险环节 控制措施 细胞沉淀困难 稀释样本1:4 PBS后重复离心 柱效下降 严格4℃预冷分选柱 抗体非特异结合 FcR阻断剂+冰上操作 DC活性损失 MACS缓冲液全程冰浴 注:完整流程耗时约3小时,DC得率约0.1-0.5% PBMC(文献实测数据)


