实验步骤
- 1
- 2
- 3
-
分析步骤
一般而言,DC具有分泌促炎和免疫调节因子的能力,这取决于它所接受的刺激。T细胞介导的CD40L刺激Mo-DCs可诱导产生极化的Th1 分泌IL-12,同时也可诱导免疫抑制性IL-1012-14的分泌。然而,对于癌症治疗发展的研究,我们希望产生分泌大量IL-12和少量IL-10的Mo-DC人群,因为这些细胞通过诱导TH1细胞产生更有效的抗肿瘤反应。
可以在各种条件下刺激Mo-DC以确定它们分泌IL-12和IL-10的能力;也可以将它们与可溶性的人来源CD40-配体孵育,这样可以在体外形成多聚体;也可以与表达CD40L的J558L细胞系共培养。
(1)用RPMI 1640培养基重悬mMo-DC细胞,密度为5×106个/mL,其中培养基中添加2 mM L-谷氨酰胺和1%自体血清
(2)向96孔板的每个孔中接种5×105个细胞。
(3)向每个孔中加入16 µg / mL人CD40-配体以刺激mMo-DC。为了进行比较,将mMo-DC与表达CD40L的J558L细胞系以不同的密度(7×104、14×104或28×104细胞/每孔)共培养。
(4)Mo-DC在37°C,5%CO2培养箱中孵育24小时。
(5)收集细胞上清液,并以300×g离心10分钟以去除其他细胞。
(6)通过特定的ELISA(eBioscience)确定IL-12p70和IL-10的浓度。
-
代表性分析结果
可溶性CD40L刺激Mo-DCs可产生高水平的IL-12和低水平的IL-10,Mo-DCs与表达CD40L的J588L细胞共培养后,IL-12和IL-10的分泌量总体增加。然而,可溶性CD40L刺激后的IL12 / IL-10的比例高于与细胞系共培养后的比例。因此,与CD40L转染的细胞系相比,重组人CD40L多聚体是一种更优的选择,可以在特定条件下刺激Mo-DCs。
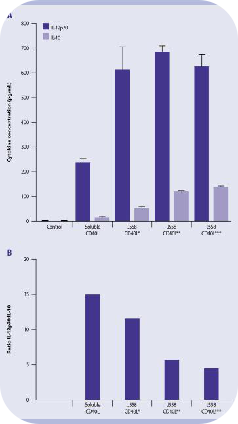
△点击放大图片
图注:CD40L刺激后,mMo-DC分泌IL-12和IL-10的能力。
(A)在不存在或存在可溶性CD40L(16μg/ mL)或表达CD40L的J558细胞系(7×10⁴、 14×10⁴、28×104个细胞/孔)的情况下,将mMo-DC培养24小时。采用ELISA法测定培养上清液中IL-12p70和IL-10的浓度。
(B) IL-12p70与IL-10的比值是根据(A)的结果计算的。
-
所需试剂和耗材
单核和T细胞的分选 CD14 MicroBeads, human (# 130-050-201) CD4 MicroBeads, human(#130-045-101) Pre-Separation Filters, 30 μm (# 130-041-407) MACS Columns and MACS Separators MO-DC的诱导条件 重组细胞因子Human GM-CSF, 重组细胞因子Human IL-1β 重组细胞因子Human IL-4 重组细胞因子Human IL-6 重组细胞因子Human TNF-α Human PGE2; PMRI基本培养基+TexMACS培养基 流式鉴定流式抗体 CD11C, CD80, CD86, CD83, HLA-DR, CD14, CD4, CD209, CD197


