如下操作步骤以产品货号29343045的步骤为例,产品列表详见右下方推荐产品
一种能够获得高质量DNA产物的核酸纯化试剂盒;纯化后的核酸纯度高,无盐离子残留,无需离心或过滤;既可以手工操作,也可以使用自动化工作平台以96孔或384孔板的形式完成。
实验步骤
- 1
- 2
- 3
- 4
- 5
- 6
-
Sera-Mag 选择 尺寸选择和 PCR 纯化试剂
Sera-Mag™ Select PCR 纯化和大小选择试剂基于众所周知的固相可逆固定技术,用于选择性结合 DNA 片段,用于下一代测序 (NGS) 等应用和聚合酶链式反应 (PCR) PCR 净化(图 1)。它结合了磁珠技术的便利性,利用 Sera-Mag Carboxyl SpeedBeads 的卓越结合特性和优化的结合解决方案,采用即用型配方。
Sera-Mag Select 在一个即用型解决方案中为 DNA 净化、回收和大小选择提供了灵活的解决方案。
通过调整与固定体积样品混合的试剂量,可以调整从过程中分离的 DNA 大小范围以满足用户的要求,从总回收率到窄范围大小选择。作为一般规则,要结合的 DNA 片段越小,应添加的试剂体积就越大(相对于初始样品体积)。使用 Sera-Mag Select 可以可靠地回收 100 bp 或更大的 DNA,从而有效去除引物、核苷酸和接头。不同的操作手册中详细的描述了如何操作。 -
PCR 净化
Sera-Mag Select 可用于在循环后清理 PCR 产物,去除未使用的寡核苷酸、PCR 缓冲液成分和酶。通过洗脱到比输入样品更小的缓冲液体积,浓度可以增加洗脱的 DNA。
使用 28 mer 正向和反向引物从 lambda DNA 模板生成 PCR 产物 (1352 bp)。
该粗产物中加入了额外的引物,最终浓度为 20 µM,以加强纯化。通过将 80 µL Sera-Mag Select 添加到 100 µL PCR 产物(0.8 倍比率)中进行清理。洗涤和干燥后,将 1352 bp PCR 产物洗脱到不同体积的 1x TE 缓冲液中,并通过凝胶电泳进行分析(图 2)。
图 1. Sera-Mag Select PCR 净化和大小选择试剂基于可逆固定技术,用于选择性结合 DNA 片段。△点击放大图片
使用 0.8 倍的比率,我们看到 PCR 产物中所有掺入的引物都被有效去除,即使在小体积洗脱并加载到凝胶上时也是如此。通过选择正确的比例,这种左侧纯化模式非常适合去除未使用的引物、核苷酸和接头。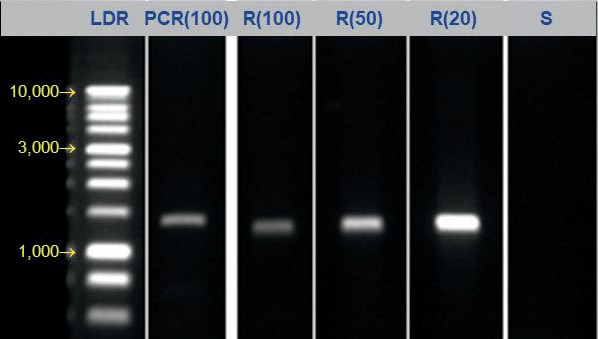
图 2. 加标 PCR (100 µL) 与 80 µL Sera-Mag Select 试剂混合并按照方案中所述进行处理: Lane PCR(100) 显示 PCR 使用过量引物;泳道 R(x) 显示在 100 µL、50 µL 和 20 µL 体积下的洗脱。△点击放大图片
-
DNA 恢复
回收率会受到所用试剂比例的影响。
我们建议在实施新工作流程之前优化比率以获得最佳结果。当有效比率已经建立时,应该不需要从运行到运行进行更改。 Sera-Mag Select 每次都能提供可重复的结果。
为了显示回收性能,使用 Sera-Mag Select 结合商业 250 bp DNA 片段,洗脱后,回收率计算为输入的百分比。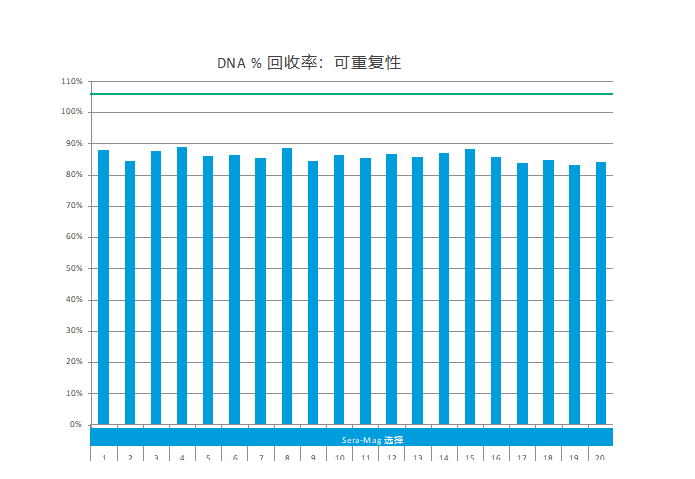
图 3. 使用 Sera-Mag Select 试剂结合并回收 20 个重复的 250 bp DNA 片段。所得样品通过 Qubit dsDNA HS Assay 进行分析。△点击放大图片
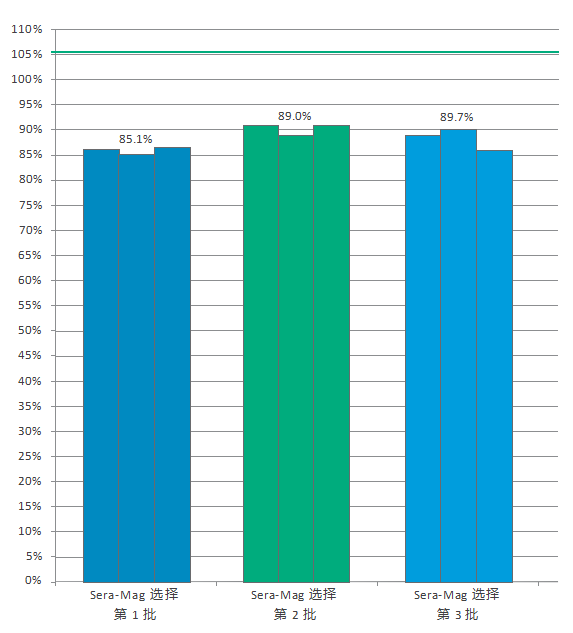
图 4. 三批不同的 Sera-Mag select 分别用于结合和恢复 250 bp DNA 片段的三个重复。所得样品通过Qubit dsDNA HS Assay 进行分析。△点击放大图片
使用 Sera-Mag Select 单独纯化多个等分试样 (50 µL) 的 250 bp DNA 片段。 DNA 以 1.5 倍的比例(75 µL 试剂)结合,并根据标准回收方案进行处理。通过 Qubit™ (Thermo Fisher Scientific) 分析回收的片段(图 3)。
使用 Sera-Mag Select 的多次重复的恢复水平是一致的,并且对于 250 bp 的 DNA 片段的恢复显示出出色的可重复性。
为了证明批次间的一致性,我们测试了三个不同批次的 Sera-Mag Select 的恢复效率,再次使用 250 bp DNA 片段来确定批次之间的重现性。
用三个不同批次的 Sera-Mag Select 分别纯化三个重复 (50 µL) 的 250bp DNA 片段。 DNA 以 1.5 倍的比例(75 µL 试剂)结合,并根据标准回收方案进行处理。通过 Qubit 分析回收的片段(图 4)。
从对三个不同批次的 Sera-Mag Select 的谨慎测试可以看出,批次之间的 DNA 回收率是可重复的,一次又一次地提供可靠的性能。 -
双面尺寸选择
除了有效的 PCR 净化外,良好的大小选择对于下一代测序 (NGS) 的许多文库制备工作流程至关重要。从片段化的 DNA 样本中成功选择小范围大小的能力提高了测序效率,从而获得了更好的数据质量。通过选择正确的试剂与样品比例,可以优化大小选择
给定的目标大小,通过在第一轮中去除较高分子量的 DNA,然后在第二轮中去除较低分子量的 DNA。
使用 NEBNext™ dsDNA Fragmentase™ (New England Biolabs / NEB) 对人类基因组 DNA 进行片段化,并使用三种不同的试剂比例对 100 ng 的片段化 DNA 进行双面大小选择(表 1)。回收的 DNA 在 50 µL TE 中洗脱,1 µL 使用高灵敏度 DNA 芯片在 Bioanalyzer™ (Agilent™) 2100 上运行(图 5)。
表 1. 用于制备高 (HI)、中 (MED) 和低 (LO) DNA 片段大小的 Sera-Mag Select 的左侧和右侧比例。尺寸选择试剂应用水平 尺寸范围 第一轮(右侧) 第 2 轮(左侧) HI 0.40x 0.50x MED 0.50x 0.65x LO 0.65x 1.00x 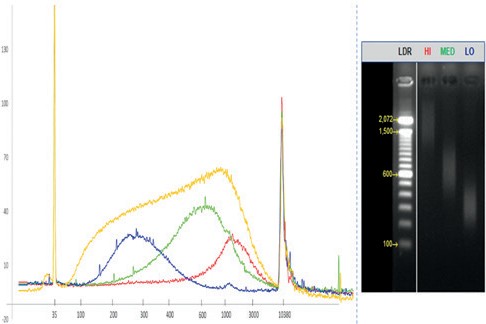
图 5. 三种不同大小的选择,高 (HI)、中 (MED) 和低 (LO),使用三种不同比例从片段化的基因组 DNA 中分离Sera-Mag 选择。输入样本包含在(黄色)中。通过生物分析仪和凝胶电泳(分别为左和右)进行分析。△点击放大图片
结果:(以橙色输入样本参考轨迹)。
第二个实验 SeraMag Select(以 SeraMag 的 350bpn 调整比率为中心)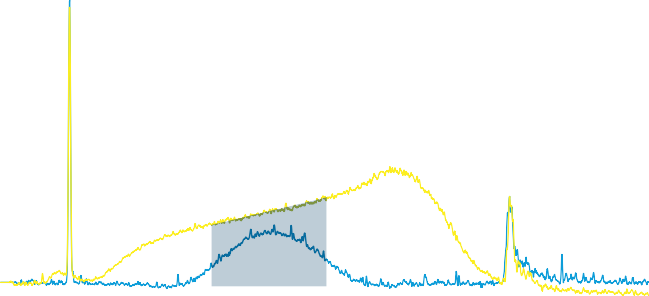
图 6. 使用 Sera-Mag Select(蓝色)对 DNA 片段进行双重尺寸选择,以 350 bp 为中心,从片段化的基因组 DNA 中分离出来,并使用 Bioanalyzer 2100 使用高灵敏度 DNA 芯片(安捷伦)进行分析。△点击放大图片
通过控制与样品体积相关的试剂体积,很明显,可以优化尺寸选择以满足用户的需求。增加在第一轮中添加的 Sera-Mag Select 试剂的量,然后在第二轮中产生更高的最终比率会降低回收的平均大小。
为了进一步研究性能,碎片化的人类基因组 DNA 输入样本按照产品随附的协议进行处理,以分离以 350 bp 为中心的目标片段大小。
人类基因组 DNA 使用 NEBNext dsDNA 片段酶 (NEB) 进行片段化,并对 100 ng 片段化的 DNA (50 µL) 进行双面尺寸选择,试剂体积与输入样本体积的比例为给定(表 2)。使用高灵敏度 DNA 芯片在 Bioanalyzer 2100 上运行回收的 DNA(图 6)。
表 2. 用于从片段化的人类基因组 DNA 中分离 350 bp 范围的大小选择试剂的相对比率。尺寸选择试剂应用水平 尺寸选择化学 第一轮(右侧) 第 2 轮(左侧) Sera-Mag 选择 0.60x 0.85x
总之,Sera-Mag Select 为 PCR 净化和 DNA 大小选择提供了单一的解决方案,方便Sera-Mag Carboxyl SpeedBeads 磁性颗粒经过验证的性能。我们已经展示了从 PCR 产物中有效去除寡核苷酸的效果,并展示了符合行业要求的 DNA 回收率和大小选择性能。 -
批次间一致性
在任何 NGS 工作流程中实施新解决方案时,可重复性和可靠性是每次为每项操作提供一致性的重要考虑因素。为了消除这些顾虑,Sera-Mag Select 的生产和质量控制旨在确保将工艺变化保持在最低限度。为了证明双尺寸选择中的批次间重现性,使用了四个不同批次的 Sera-Mag Select 对片段化 gDNA 进行尺寸选择。对结果进行了比较(图 7)。
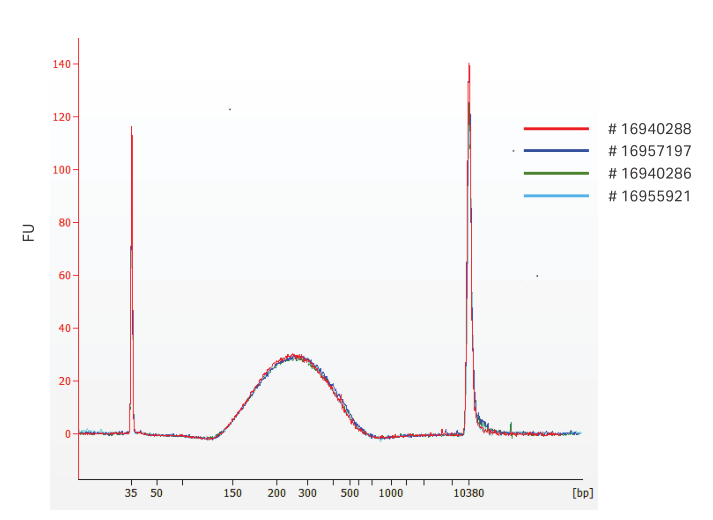
图 7. 片段 DNA 的双重大小选择; Sera-Mag Select™ 批次间比较。△点击放大图片
使用 NEBNext dsDNA Fragmentase 对人类基因组 DNA 进行片段化,并使用四个不同制造批次的 Sera-Mag Select 对 100 ng 片段化 DNA(TE 中 100 µL)进行以 300 bp 为中心的双面大小选择。简而言之,通过涡旋将珠子与样品以 0.575x 样品体积混合,并在室温下孵育 10 分钟。
使珠子沉降在磁体上,保留上清液并使用 0.9x 的总比进行第二轮尺寸选择。在室温下孵育 10 分钟后,使珠子沉降在磁体上并弃去上清液。
将珠子用 85% 乙醇洗涤两次并在室温下干燥 5 分钟。在室温下孵育 10 分钟后,使用 50 µL TE 缓冲液洗脱 DNA,并使用高灵敏度 DNA 芯片在 Bioanalyzer 上运行 1 µL。
总之,对于测试的四批 Sera-Mag Select 中的每一批,来自每个大小选择的 DNA 片段的大小分布显示出重叠,表明批次之间的一致性非常高。 -
基准测试
Sera-Mag Select 在广泛的并行研究中与几种替代产品进行了测试,以清楚地证明在清洁和尺寸选择方面的性能(图 8-11)。
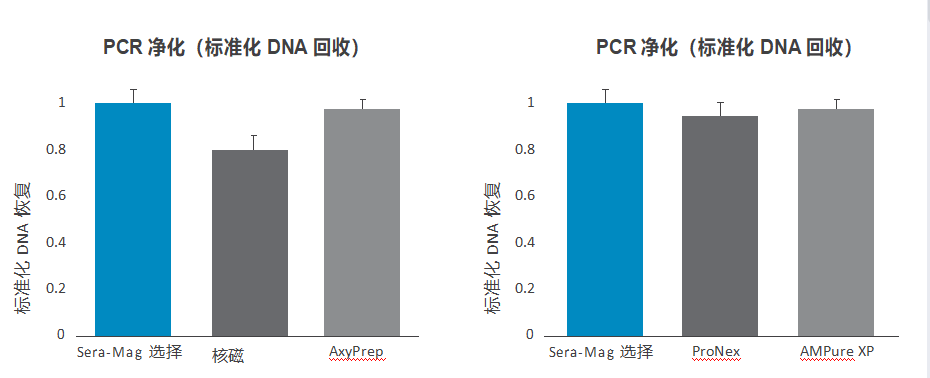
图 8. PCR 净化中的总 DNA 回收率。△点击放大图片
对含有 250bp DNA 片段的 PCR 反应混合物 (50 µL) 进行 DNA 净化。简而言之,Sera-Mag Select 是通过涡旋以 1.5 倍的样品体积与样品混合,并在室温下孵育 10 分钟。使珠子沉降在磁体上并弃去上清液。将珠子用洗涤缓冲液(70% 乙醇、20mM Tris pH 8.5、50mM NaCl)洗涤两次并干燥在 40°C 下 10 分钟。在 40°C 下孵育 15 分钟后,使用 50 µL TE 缓冲液洗脱 DNA。
对于 NucleoMag (Macherey-Nagel)、AxyPrep (Dutscher)、ProNex (Promega Corporation) 和 AMPure XP (Beckman Coulter),按照制造商的方案进行 PCR 净化。使用 Qubit dsDNA HS 试剂对DNA 进行定量。图表代表在三个独立实验中获得的数据,标准化为 Sera-Mag Select,误差线代表标准偏差(图 8)。使用带有 Dunnett 事后检验的单向Anova 进行统计分析。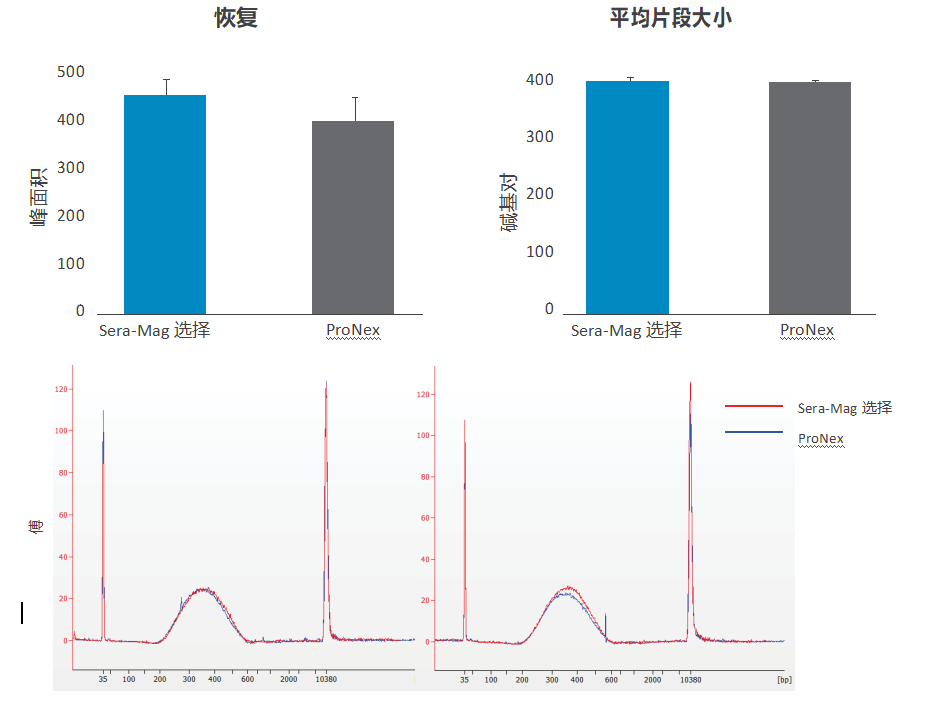
图 9. 片段 DNA 的双重大小选择; Sera-Mag Select 与 ProNex。△点击放大图片
使用 NEBNext dsDNA Fragmentase 对人类基因组 DNA 进行片段化,并对 100ng 片段化 DNA(TE 中 100 µL)进行以 350/400bp 为中心的双面大小选择。简而言之,Sera-Mag Select 通过涡旋以 0.585x 样品体积与样品混合,并在室温下孵育 10 分钟。使珠子沉降在磁体上,保留上清液并进行第二轮尺寸选择使用0.85x的总比例。在室温下孵育 10 分钟后,使珠子沉降在磁体上并弃去上清液。将珠子用洗涤缓冲液(70% 乙醇、20mM Tris pH 8.5、50mM NaCl)洗涤两次,并在 40°C 下干燥 10 分钟。
在 40°C 下孵育 15 分钟后,使用 50 µL TE 缓冲液洗脱 DNA。按照制造商协议的建议,ProNex 使用1.1x/1.45x 的比率。脱氧核糖核酸使用 Bioanalyzer 涂片分析在 200-800bp 之间的区域(峰面积和平均片段大小)计算回收率。图表代表在四个独立实验中获得的数据,误差条代表 SEM。使用配对 2 尾学生 t 检验(上图)进行统计分析。下图显示了使用 Sera-Mag Select 和 ProNex(分别为红色和蓝色)选择大小的 DNA 的代表性 Bioanalyzer 痕迹(图 9)。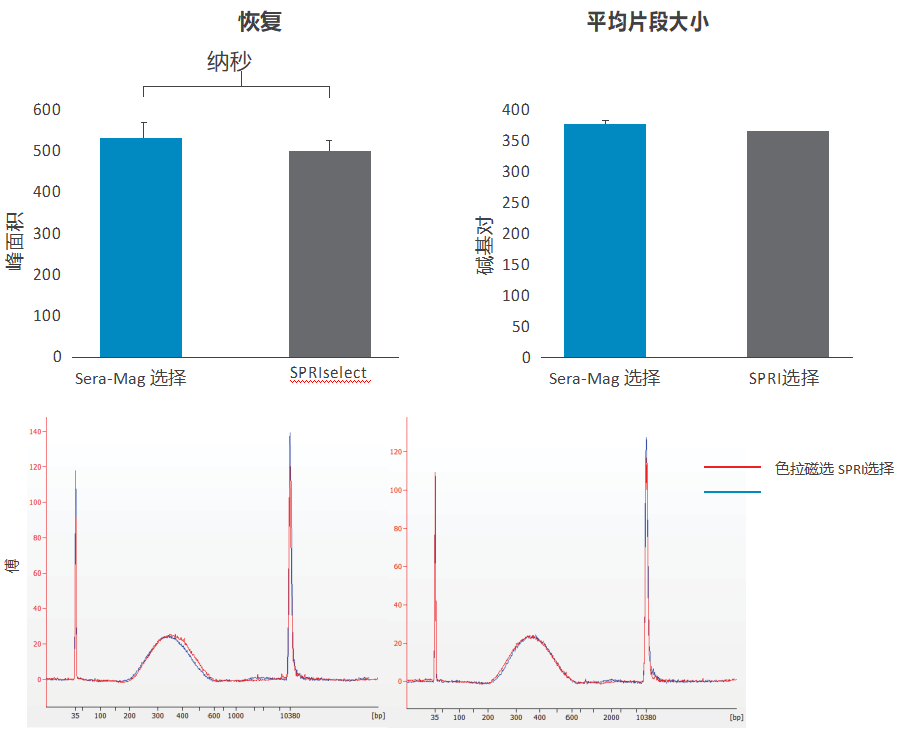
图 10. 片段 DNA 的双重大小选择; Sera-Mag Select 与 SPRIselect。△点击放大图片
使用 NEBNext dsDNA Fragmentase 对人类基因组 DNA 进行片段化,并对 100ng 片段化 DNA(TE 中 100 µL)进行以 350/400bp 为中心的双面大小选择。简而言之,Sera-Mag Select 通过涡旋以 0.6 倍样品体积与样品混合,并在室温下孵育 10 分钟。使珠子沉降在磁体上,保留上清液并进行第二轮尺寸选择使用0.825x的总比例。在室温下孵育 10 分钟后,使珠子沉降在磁体上并弃去上清液。将珠子用 85% 乙醇洗涤两次并在室温下干燥 5 分钟。DNA 被洗脱在室温下孵育 10 分钟后,使用 50 μL 的 TE 缓冲液。 SPRIselect (Beckman Coulter) 使用 0.6x/81x 的比率,如制造商协议建议的那样。使用 Bioanalyzer 涂片分析在 200-800bp 之间的区域(峰面积和平均片段大小)。图表代表在五个独立实验中获得的数据,误差条代表 SEM。使用配对 2 尾学生 t 检验(上图)进行统计分析。
下图显示了使用 Sera-Mag Select 和 SPRIselect(分别为红色和蓝色)选择的 DNA 大小的代表性Bioanalyzer 痕迹。 (图 10)。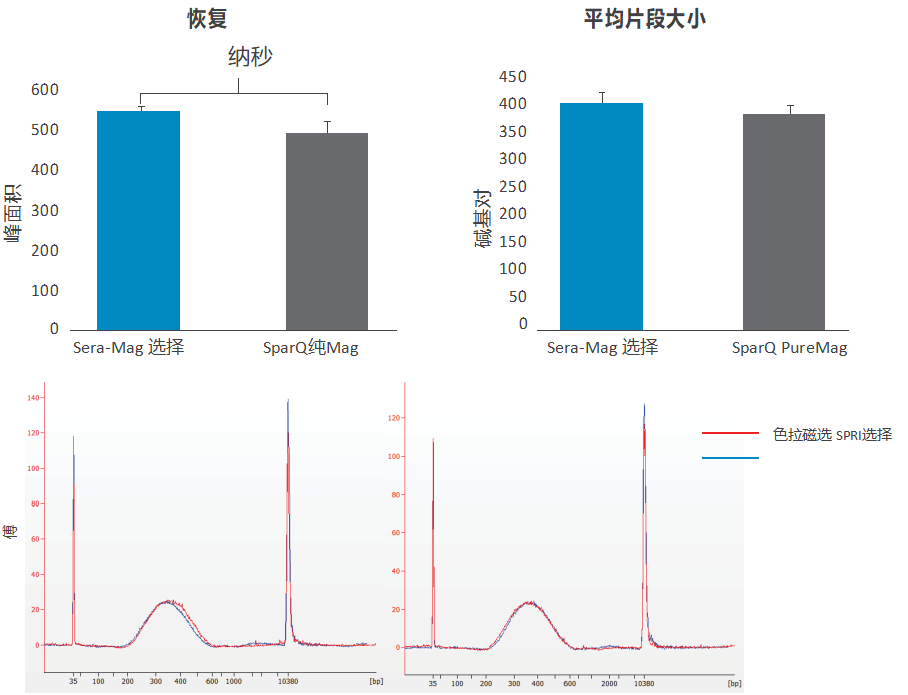
图 11. 片段 DNA 的双重大小选择; Sera-Mag Select 与 SparQ PureMag 磁珠。△点击放大图片
使用 NEBNext dsDNA Fragmentase 对人类基因组 DNA 进行片段化,并对 100ng 片段化 DNA(TE 中 100 µL)进行以 350/400bp 为中心的双面大小选择。简而言之,Sera-Mag Select 通过涡旋以 0.57x 样品体积与样品混合,并在室温下孵育 10 分钟。使珠子沉降在磁体上,保留上清液并进行第二轮尺寸选择使用0.78x的总比例。在室温下孵育 10 分钟后,使珠子沉降在磁体上并弃去上清液。将珠子用 85% 乙醇洗涤两次并在室温下干燥 5 分钟。 DNA 被洗脱在室温下孵育 10 分钟后,使用 50 μL 的 TE 缓冲液。按照制造商协议的建议,SparQ PureMag 珠子 (Quantabio) 的比率为 0.6x/8x。使用 Bioanalyzer 涂片分析在 200-800bp 之间的区域(峰面积和平均片段大小)计算 DNA 回收率。图表代表在七个独立实验中获得的数据,误差条代表 SEM。使用配对 2 尾学生 t 检验(上图)进行统计分析。下图显示了使用 Sera-Mag Select 和 SparQ PureMag 微珠(分别为红色和蓝色)选择大小的 DNA 的代表性 Bioanalyzer 痕迹(图 11)。
该数据基于至少三个独立实验/重复试验,包括每个实验中至少两个重复。所有测试的样品都被平等对待(与比较中测试的所有产品的重复次数相同)并根据制造商的协议/建议。数据于 2018 年 9 月至 2019 年 2 月和 2019 年 2 月至 2019 年 2 月(分别为总 DNA 回收率和大小选择)期间在英国卡迪夫梅纳德中心的 Cytiva 收集并保存在该位置。


