背景介绍
BACKGROUND
免疫疗法(Immunotherapy),乃是着重于强化免疫系统功能,助力其重拾识别并彻底清除癌细胞能力的一种治疗手段。其涵盖多种形式,例如 CART 疗法、免疫检查点抑制疗法,将无害化肿瘤当作疫苗进行注射、注入可感染肿瘤细胞的溶瘤病毒、运用刺激 T 细胞活化的 IL - 2,以及放疗化疗等。
过继 T 细胞疗法(Adoptive T cell therapy, ACT)属于新兴免疫治疗途径,主要有以下三类:其一,在肿瘤组织内分离筛选淋巴细胞,随后于体外借助 IL - 2 诱导其扩增;其二,采用基因编辑技术为 T 细胞添加 TCR 或者 CAR,从而让 T 细胞能够精准识别特定肿瘤抗原;其三,提取外周血中的 PBMC 细胞,利用携带特异性抗体的 APC 予以刺激,再经过筛选后回输人体。
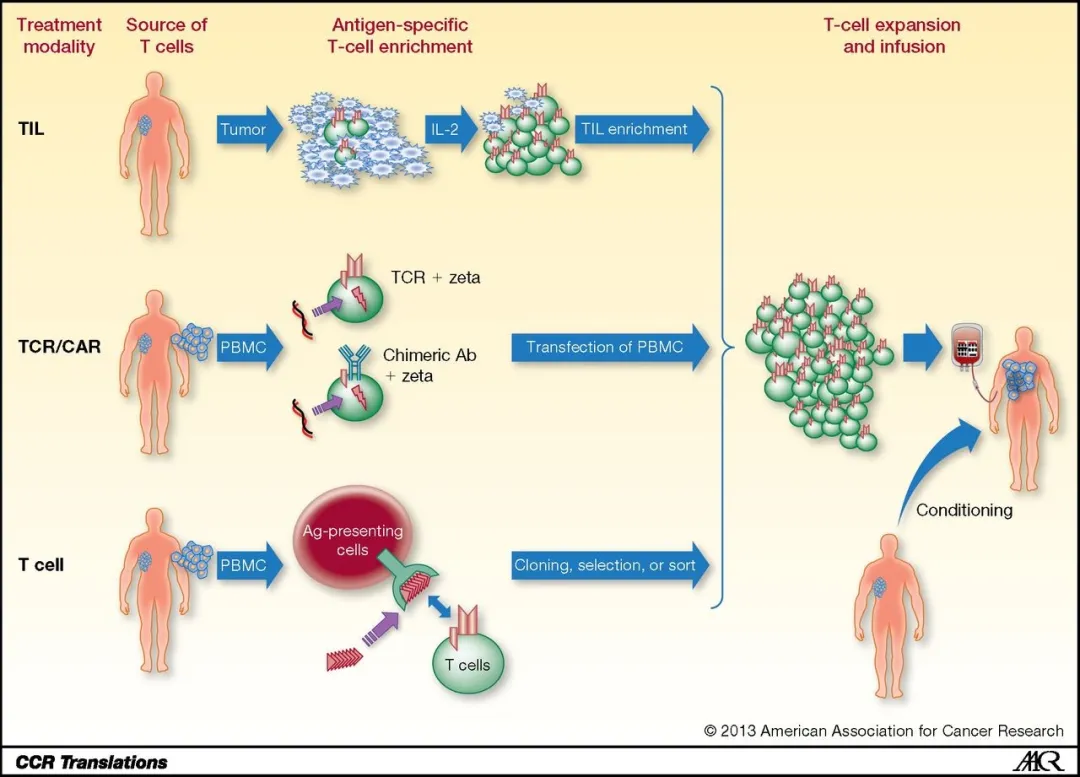
肿瘤浸润淋巴细胞(Tumor Infiltrating Lymphocytes, TILs),是从肿瘤组织中分离提取出的浸润淋巴细胞。其中存在部分专门针对肿瘤特异性突变抗原的 T 细胞,这类细胞犹如深入敌营且战斗力最强的先锋,被视作机体对肿瘤细胞产生的特异性免疫反应的关键力量。与其他外周血细胞回输治疗相比,它有着显著差异。外周血细胞的肿瘤靶向性相对薄弱,并且若是经单一抗原刺激的外周血细胞,在杀伤肿瘤过程中极易引发免疫耐受现象。而 TILs 源于肿瘤组织内部,故而具备极为强劲的靶向性与杀伤效能。
ACT - TILs 在临床应用中的操作流程大致如下:首先在肿瘤组织里分选淋巴细胞,在体外添加 IL - 2 以实现少量扩增,接着利用 anti - CD3 和 IL - 2 来刺激 TILs 大量增殖。与此同时,患者在接受 TILs 回输之前,需要注射两种化疗药物,目的在于耗竭宿主淋巴细胞并清除 Treg 细胞,以此增强回输的 TIL 细胞在体内的持久性。
TILs 治疗效果受多种因素左右。2011 年,Restifo 等人于 Clinical cancer research 杂志发表研究成果指出,CD8 T 细胞的分化状态对 TIL 治疗效果有着重要影响。例如,回输干细胞样的 central memory 细胞能够对 B16 肿瘤的生长发育产生作用,并延长生存期。不过,关于人类 TILs 表型与治疗效果之间的关联,目前尚未有相关数据报道。
文章内容
CONTENTS
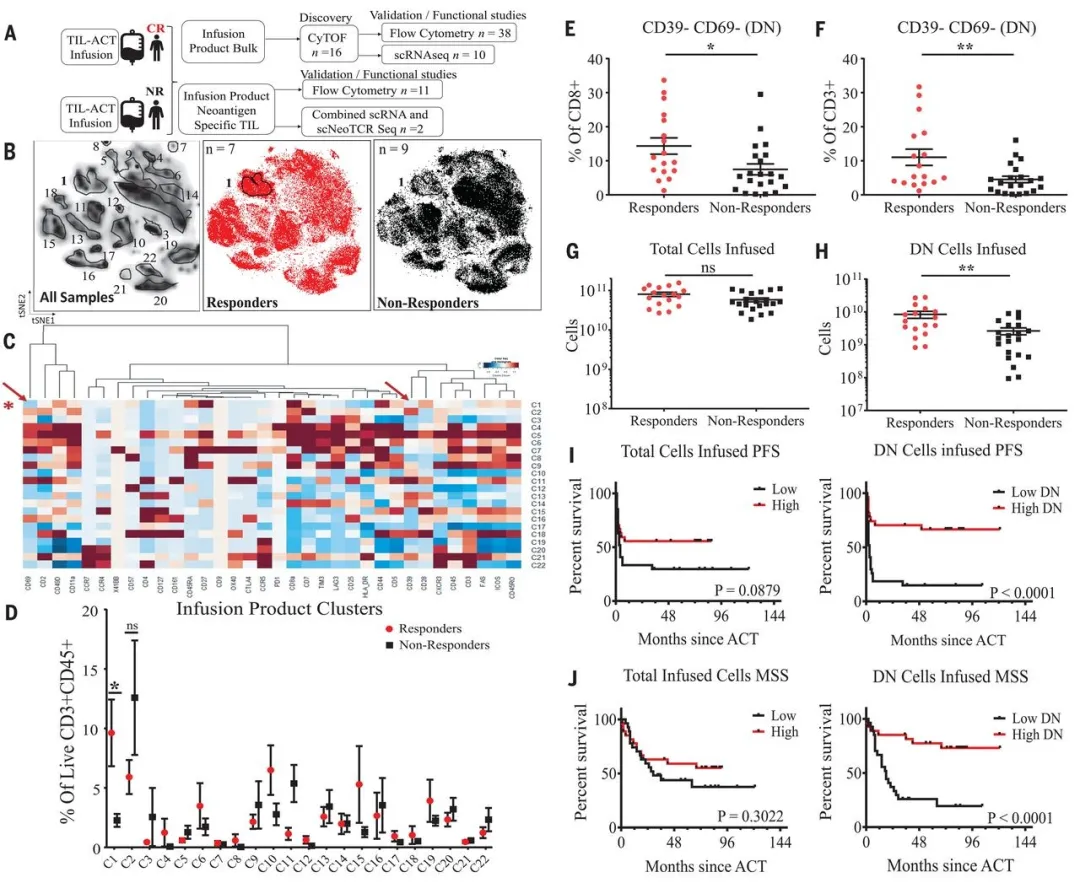
一、TILs 回输治疗有效组与无效组的表型图谱对比
研究人员选取了接受 TILs 回输治疗且被判定为治疗有效(CR)以及无效(NR)的两批患者在治疗时所回输的细胞。这些患者的 TILs 在回输前未经过特定方向的筛选,并且在回输前未接受其他基因编辑 T 细胞治疗或免疫检查点治疗。借助质谱流式技术对 7 位 CR 患者和 9 位 NR 患者的细胞展开单细胞分析,结果显示有 34 个细胞表面标志物呈现出异质性。其中 Cluster One 在 CR 组中的表达量相较于 NR 组高出 4 倍。这一细胞群主要为高表达 CD44、CD27、CD28 的 CD8+T 细胞,同时其 TIM3、CD39 和 CD69 的表达量较低,这意味着该群细胞具有干细胞样和记忆样 T 细胞的特征。此外,高表达 CD39 和 CD69 的 Cluster2 细胞群在 NR 组中的含量高于 CR 组。研究人员进一步运用机器学习方法,对患者的临床特征与 T 细胞表面标志物的相关性进行分析,发现 CD39 和 CD69 的表达量与临床症状之间的相关性最为突出。
研究人员采用流式细胞分析技术对两组患者回输细胞中 CD39 和 CD69 的差异进行检测。发现在 CR 组中,DN 细胞(双阴性细胞,即 CD39 和 CD69 双阴性)的含量相对较多,这表明该 DN 亚群与 ACT(过继性 T 细胞疗法)反应存在关联。这两群患者回输的细胞总量并无差异,然而回输的 DN 细胞数量却存在明显不同。DN 细胞的数量对患者接受治疗后的无进展生存率有着显著影响,而 DP 细胞(双阳性细胞)的数量与生存率之间的差异则并不显著。
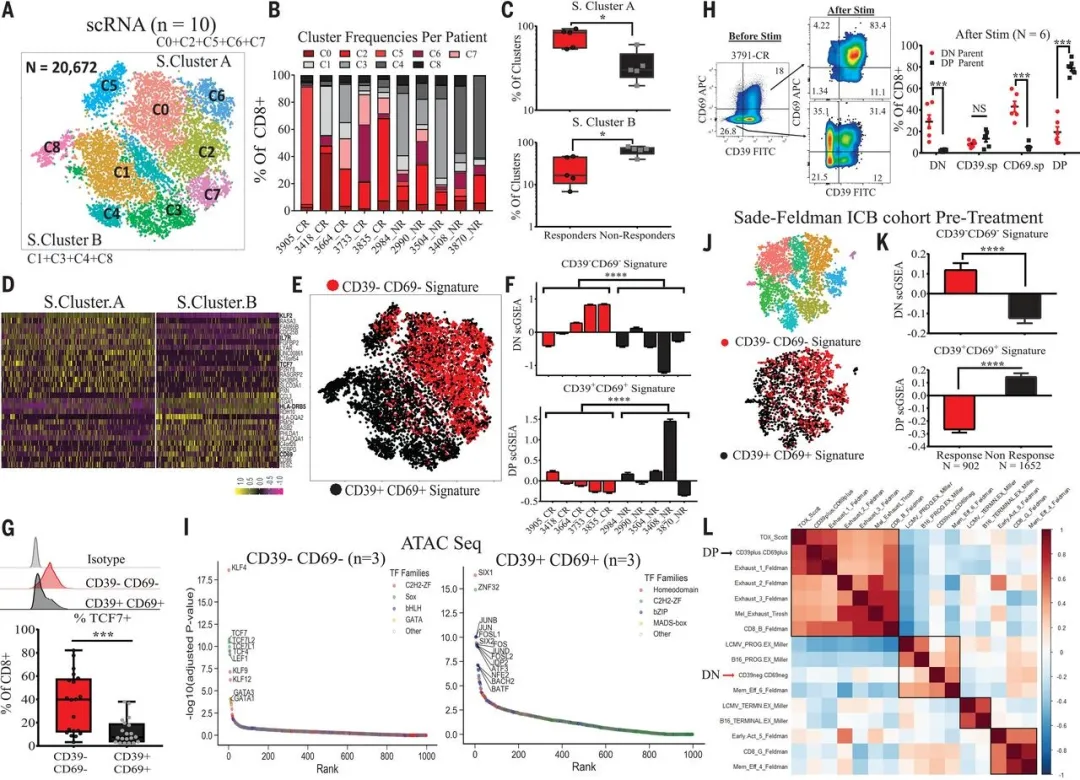
二、CD39–CD69– CD8+ TIL 呈现记忆干细胞样特性
研究人员对 DP 和 DN 两组细胞的 RNA - seq 数据展开分析,结果显示 DN 细胞高度表达与静息干细胞样 T 细胞相关的标志物,如 KLF2、TCF7、S1PR1、LEF1、IL7R、CD27、SELL(CD62L),而 DP 细胞则高表达分化激活 T 细胞相关标志物,像 CD38、MKI67、TNF、IFNG。随后,研究人员针对 5 个 CR 组和 5 个 NR 组进行了 scRNA - seq,依据不同的耗竭或活化标志物将其划分为 9 个 cluster,再按照这些 cluster 在 CR 和 NR 组中的占比差异,整合形成 super cluster A 和 super cluster B。CR 患者的 TILs 在 s.cluster A 中的比例较高,NR 患者的 TILs 在 s.cluster B 中的比例较高。并且 S Cluster A 与 DN 细胞表达的基因具有高度一致性,S Cluster B 与 DP 细胞表达的基因呈现高一致性,scGESA 也证实了上述结论。同时,研究人员发现 T 细胞耗竭标志物 PD1、TIM3 在 DN 细胞中的表达量较低,而记忆细胞相关标志物 CD62L、CD27 以及祖细胞标志物 SLAMF6 在 DN 细胞中的表达量有所升高。
就记忆干细胞样 T 细胞标志物 TCF7 的表达量而言,在 DN 细胞中表达量较高,这与 scRNA - seq 数据相符。为了验证 DN 细胞属于干细胞样 T 细胞,研究人员分选了 DN、SP、DP 细胞,利用 anti - CD3/CD28 进行 120 小时的刺激,结果表明 DN 细胞具备较强的自我更新能力,并且能够向 SP 和 DP 群分化。而 DP 细胞则始终维持在 DP 状态。有趣的是,在刺激 5 天后,部分 DN 细胞又恢复到 DN 细胞的水平。这充分说明 DN 细胞具有记忆干细胞样特性,具备分化为其他亚群的潜能,而 DP 细胞则处于分化的终末阶段。
研究人员从 TIL 中进一步分选了 DN 和 DP 细胞,并开展 ATAC - seq。结果发现干细胞样 DN 细胞的染色质区域富含 SOX 和 C2H2 - ZF 家族转录因子的结合位点,包括 KLF4、TCF7、LEF1、TCF7L1,这与分化程度较低的人类 T 细胞情况一致。相反,DP 细胞染色质区域富集了 bZIP 转录因子 FOSL1、FOS、JUNB、JUND,这意味着这些细胞可能参与维持由慢性肿瘤细胞活化所导致的终末分化状态。
研究人员还分析了此前免疫检查点治疗黑色素瘤的反应性与 DN、DP 细胞之间的关系。对于免疫检查点阻断(ICB)治疗有效的病灶中的 TILs,在治疗前其 DN 表征表达较强,而 ICB 治疗无效的病灶则 DP 表征表达较强。研究人员又通过分层聚类相关性分析,对其他研究中的 T 细胞功能异常基因和祖细胞基因特征进行分析,发现 DN 细胞与 ICB 反应相关的记忆细胞以及祖细胞耗竭存在关联,DP 细胞则与 ICB 反应较弱以及终末 TILs 耗竭密切相关。
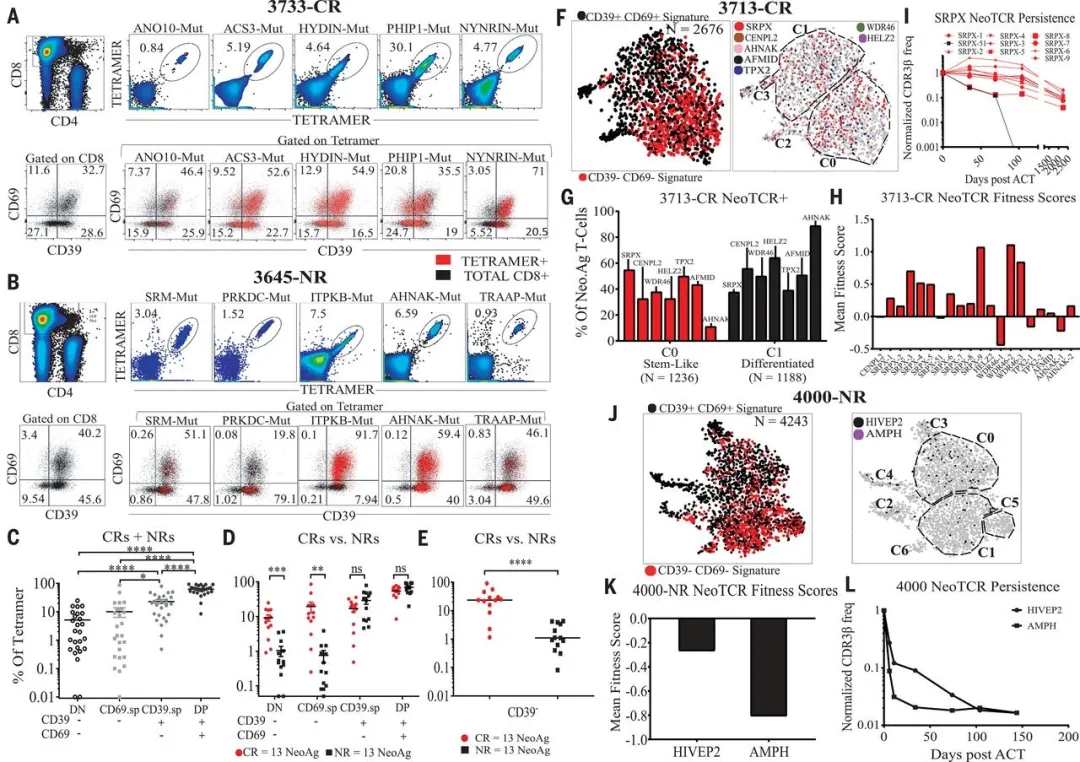
三、新生抗原特异性 TILs 的干细胞样特性
研究人员借助串连迷你基因新生抗原筛选平台,在回输的 TILs 中确定了 26 个 MHC I 类限制性新生抗原,随后试图探究哪些 TILs 对这些抗原有特异性。鉴于此前有报道指出新生抗原特异性的 TILs 主要为 CD39 + 的 T 细胞,而 CD39 - 的 T 细胞属于旁观者细胞。研究结果显示,这些新生抗原特异性的 T 细胞大多分布在 DP 细胞之中,这与先前文献报道的在 CD39+T 细胞中富集的结论相符。然而,若依据 ACT 的反应状态加以分析,在治疗有效(CR)组中回输的新生抗原特异性 TILs 里,DN 细胞的比例相较于治疗无效(NR)组更高。仅就 CD39 这一单一标志物而言,CR 组 TIL 中 CD39 - 细胞里新生抗原特异性 TILs 的比率与细胞数量均显著高于 NR 组。这表明在 CR 组中,存在一个肿瘤新生抗原反应性 TILs 亚群,其以 CD39 - 干细胞样状态存在,并非如先前报道所描述的那样仅仅是旁观者 T 细胞。
研究人员对一个 CR 病例和一个 NR 病例回输的新生抗原特异性 TILs 进行联合 scRNAseq 和 scTCR 测序。在 CR 病例中可划分出两个主要群体:C0 和 C1,其中 C0 代表干细胞样 DN 时期,C1 代表分化的 DP 时期。研究发现,在 CR 病例里,免疫主导的 SRPX 突变特异性新生抗原 TCR 在 C0 处富集,而其他 TCR 在 C0 和 C1 区域的分布具有可变性。
由于此前有报道称 T 细胞的差异性可能会对 ACT 治疗后的 TCR 克隆型的持续性产生影响。研究人员对三千多例患者在接受 ACT 治疗后的外周血进行分析。通过检测 CDR3b(TCR 上的 V 区),发现多数 CR 患者的 TCR 克隆型能够持续长达 45 个月,这与 TILs 从干细胞样细胞分化而来的结果相契合。
研究人员又对 NR 组病人进行分析,发现了干细胞样细胞群 C1 和 C5,以及分化细胞群 C0。但新生抗原特异性 TCR 阳性的细胞主要分布在分化细胞群 C0 区域,这些细胞中 DP 细胞较多,这意味着这些细胞均处于终末分化状态。对治疗后的外周血分析显示,NR 组的 TCR 克隆型持续性很差,大约在 150 天左右就开始减退。结果表明,治疗反应性与 TCR 持久性之间存在关联。
四、干细胞样 TILs 对肿瘤的抗肿瘤活性及 TCR 持续性的介导作用
上述研究成果显示,ACT 后 T 细胞内在表型的差异与预后存在关联,不过其他因素,例如针对不同肿瘤抗原的 TCR 亲和力,亦可能在 T 细胞持久性方面发挥作用。研究人员为此开展了验证性实验。他们对一位患有转移性滑膜细胞肉瘤的患者进行了分析,该患者接受了自体外周血单核细胞的转移治疗,回输的单核细胞是针对 NY - ESO - 1 表位具有特异性的细胞,且该患者预后良好,属于 CR 组。研究人员以内源性的 TCRb 作为标记,用以追踪治疗后外周血中的 DN 和 DP 细胞。结果发现,大部分 TCR 表达于 DN 细胞,仅有少量表达在 DP 细胞上,并且 DN 细胞上的 TCR 持续性表现良好,大约能够持续 5 年左右。
为了进一步验证上述结果,研究人员在小鼠体内实施了验证性实验。他们从脾脏中分离出 Pmel - TCR 的 T 细胞,在体外进行刺激,随后分选 DN 和 DP 细胞,并将其回输到接种了表达人 gp100 抗原的 B16 - F10 肿瘤细胞的荷瘤小鼠体内。实验结果表明,DN 细胞的回输能够对小鼠肿瘤起到控制作用,同时还可提高小鼠的生存率。
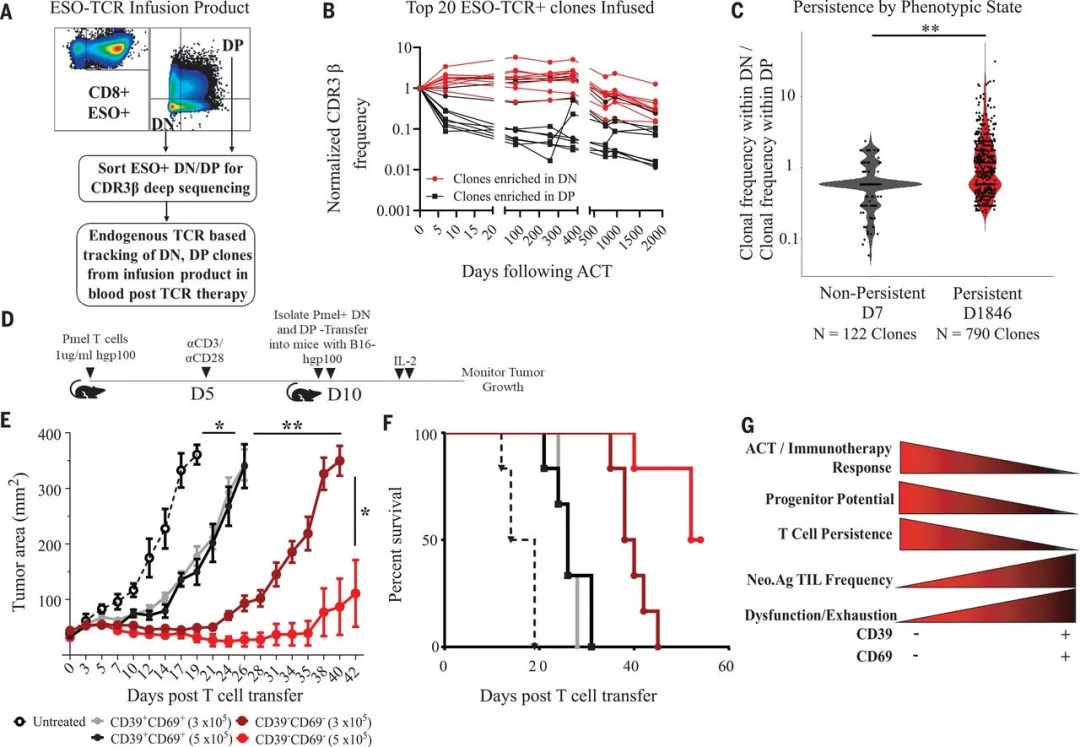
综上所述,在 TIL - ACT 治疗中能够成功应答的患者所回输的细胞里,存在着数量众多的干细胞样新抗原特异性 TILs。这些细胞具备强大的扩增能力,可分化出不同的亚群,在长期肿瘤控制以及维持 T 细胞持久性方面发挥着关键作用。而那些针对肿瘤反应性富集的 TILs,例如 CD39 + T 细胞,则可能处于终末分化阶段,其增殖潜能相对较弱,这一现象或许是长期受到抗原刺激所导致的结果。
| 名称 | 货号 | 规格 |
| PE-Cy7 Hamster Anti-Mouse CD69(H1.2F3) | 552879 | 100ug |
| Ms CD69 PerCP-Cy5.5 H1.2F3 100ug | 551113 | 100ug |
| APC Hamster anti-Mouse CD69 Antibody(H1.2F3) | abs182393-25T | 25T |
| FITC Rat Anti-Mouse CD69 Antibody (S-878-22) | S0B1560-1ml | 1ml |







