蛋白激酶
人类激酶家族是一个庞大的群体,由大约1.7%的人类基因编码的蛋白激酶(PKs)组成。这个家族中包含了约500种真核蛋白激酶(ePKs)和大约60种非典型蛋白激酶。例如,丝氨酸/苏氨酸(Ser/Thr)蛋白激酶和丝裂原活化蛋白激酶(MAPK)均归类于ePKs,而脂质激酶则属于非典型蛋白激酶。从结构上来看,真核激酶和非典型激酶之间存在高度的相似性;然而,在序列基序方面,它们却展现出了明显的差异。
蛋白激酶,作为催化蛋白质磷酸化过程的酶,在调控细胞增殖、凋亡、代谢以及自噬等生物学功能上扮演着至关重要的角色。自噬,作为一个在饥饿、感染、缺氧等应激条件下被诱导的高度保守的分解代谢过程,对于维持真核细胞的稳态具有重要意义。然而,当自噬过程出现紊乱时,可能会导致机体的功能失调,进而引发多种疾病的发生和发展,其中包括癌症和神经退行性疾病等。

越来越多的研究证据显示,蛋白激酶是自噬过程中的关键组成部分,发挥着举足轻重的作用。具体而言,真核蛋白激酶UNC-51样激酶1(ULK1)作为自噬的启动子,已被确认为自噬囊泡形成不可或缺的蛋白质,且具备正向调控自噬的生物学功能。在正常生理状态下,哺乳动物溶酶体表面的雷帕霉素靶蛋白复合物1(mTORC1)处于激活状态,通过磷酸化ULK1和ATG13来抑制自噬的发生。然而,在饥饿条件下,mTORC1的活性受到抑制,导致ULK1和ATG13迅速去磷酸化,进而激活ULK1激酶并诱导自噬。值得注意的是,mTORC1作为一种非典型的丝氨酸/苏氨酸(Ser/Thr)激酶,对自噬具有反向调节作用。
此外,还有其他蛋白激酶,如Vps34和磷脂酰肌醇3-激酶(PI3K),在整个自噬过程中也扮演着重要角色,参与自噬体的成核和成熟过程。鉴于蛋白激酶在自噬调控中的关键作用,自噬相关蛋白激酶成为了治疗人类疾病的潜在靶点。通过小分子化合物对这些蛋白激酶进行调控,可能成为一种具有广阔前景的治疗策略。
蛋白激酶自噬过程中的关键调控因子
自噬是一个复杂而精细的生物学过程,起始于双膜囊泡——自噬体的形成。在此过程中,细胞质、多种蛋白聚集体以及功能异常的亚细胞器被包裹进自噬体,随后与溶酶体融合形成自噬溶酶体。在溶酶体内,被吞噬的物质被水解酶降解,降解产物则作为新的营养物质被释放回细胞质以供再利用。简而言之,自噬过程涵盖起始、成核、成熟、融合及降解等多个阶段。尤为重要的是,自噬的每一步都受到多种蛋白激酶的精密调控,特别是在自噬启动和自噬溶酶体形成的关键节点。基于此,我们根据自噬相关蛋白激酶的最终信号转导效应,将其划分为三大类别:正调控蛋白激酶、负调控蛋白激酶以及具有双向调控功能的蛋白激酶。
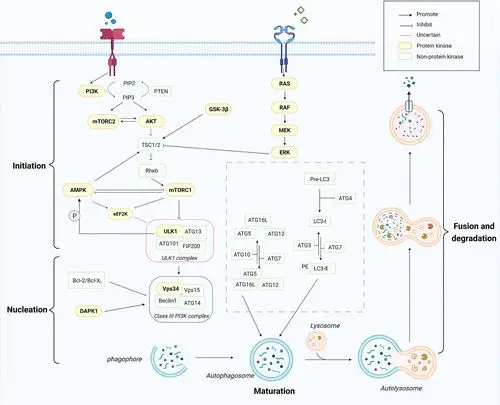
自噬的精密调控:关键蛋白激酶的角色与小分子化合物调节
自噬的正调控因子
-
AMPK(腺苷酸活化蛋白激酶)
AMPK是一种进化上保守的Ser/Thr蛋白激酶,由催化亚基(α)和两个调节亚基(β和γ)构成。它广泛参与机体的生理代谢活动,如碳水化合物、脂质和蛋白质代谢,并负责调节能量平衡。AMPK作为自噬的正调控因子,在酵母中的同源物(SNF1)已得到证实。在哺乳动物细胞中,AMPK通过多种途径调控自噬,尽管单独激活AMPK是否足以诱导自噬尚不完全清楚。 -
ULK1(UNC-51样激酶1)
ULK1是自噬启动的关键调节因子,与Atg13、FIP200、Atg101形成ULK复合体,进一步激活下游自噬信号通路,促进自噬体的形成。在透明肾细胞癌(CRCC)等研究中,干扰ULK1或抑制其活性可明显抑制癌细胞的自噬水平,诱导细胞凋亡。 -
DAPK(死亡相关蛋白激酶)和其他蛋白激酶
DAPK是一种钙/钙调素介导的Ser/Thr蛋白激酶,以其凋亡作用而闻名,但最近也被揭示在自噬中起关键作用。此外,PINK1(PTEN诱导的假定激酶1)也具有自噬正调控作用,其突变可能导致线粒体自噬障碍,这在神经退行性变中很常见。
自噬的负调控因子
-
PI3K/AKT/mTOR通路
PI3K(磷脂酰肌醇3-激酶)作为PI3K/AKT/mTOR通路的上游调控因子,被G蛋白偶联受体或受体酪氨酸激酶激活,进而调节自噬。活化的mTORC1通过磷酸化ULK1和ATG13等关键分子,抑制自噬的发生。此外,mTORC2也参与自噬的调节,但其机制可能更为复杂。 -
GSK-3(糖原合成酶激酶)
GSK-3是一种进化上保守的Ser/Thr激酶,具有负调控自噬的作用。在乳腺癌细胞中过表达GSK-3亚型可激活mTORC1并抑制自噬。抑制GSK-3则能刺激人胰腺癌细胞中的促生存自噬。
自噬的双向调节因子
RAS/RAF/MEK/ERK信号通路
该通路在不同的细胞环境中可能具有不一致的调节作用。在胰腺导管腺癌中,抑制KRAS/RAF/MEK/ERK可诱导自噬,保护细胞免受KRAS通路抑制的细胞毒作用。然而,在某些情况下,激活的RAS/RAF/MEK/ERK信号通路也能直接诱导自噬。
调节自噬相关激酶的小分子化合物
设计和开发抑制或激活自噬相关蛋白激酶的小分子调节剂是对抗癌症、神经退行性病变和其他疾病的有效策略。这些小分子调节剂包括I型、II型、Ⅲ型和Ⅳ型激酶抑制剂等,它们通过竞争性结合ATP辅因子位点或变构结合位点来调节激酶的活性。随着研究的深入,越来越多的自噬相关蛋白激酶的小分子调节剂应运而生,为这一领域带来了突破性发展。
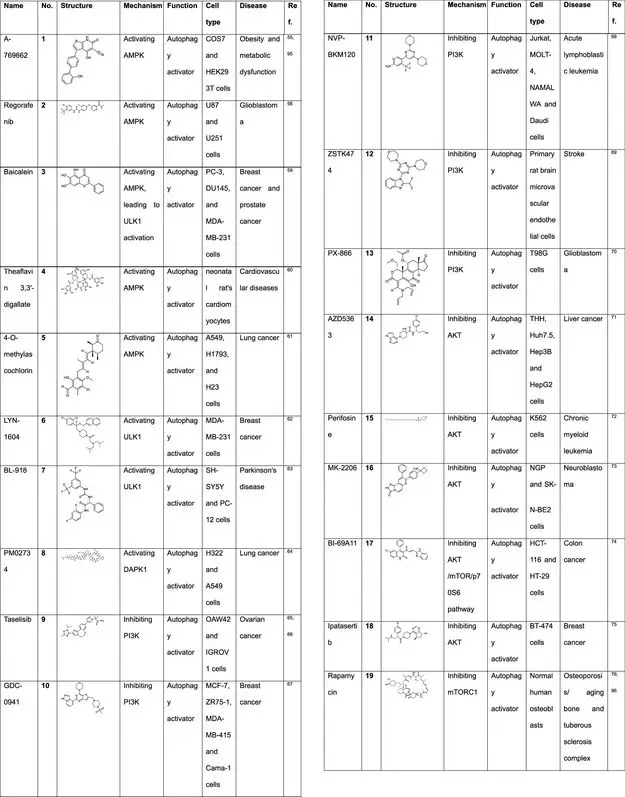
小分子自噬激活剂:AMPK激活剂的新进展
当前,一系列新型AMPK(腺苷酸活化蛋白激酶)激活剂已被证实具有诱导自噬的能力,这主要得益于AMPK在自噬过程中的正调控作用。其中,A-769662作为一种有效的AMPK激活剂,其激活效果主要依赖于β1调节亚基Ser108的磷酸化,从而有效触发自噬过程。
此外,瑞戈非尼也被报道具有激活AMPK并诱导自噬的能力。这种作用机制是通过稳定磷酸丝氨酸转氨酶1(PSAT1),进而激发蛋白激酶AMP激活的催化亚基α(PRKAA)依赖性自噬,最终抑制多形性胶质母细胞瘤的生长。这一发现不仅揭示了瑞戈非尼在抗肿瘤治疗中的新机制,也进一步证实了AMPK在自噬调控中的关键作用。
综上所述,新型AMPK激活剂如A-769662和瑞戈非尼等,通过激活AMPK并诱导自噬,为癌症治疗提供了新的策略和方向。随着研究的深入,这些小分子自噬激活剂有望在未来成为治疗多种疾病的有效药物。

自噬小分子抑制剂:蛋白激酶调节的新策略
蛋白激酶作为自噬过程中的关键调节因子,不仅具有激活自噬的作用,同样也能抑制自噬的发生。目前,已有一系列化合物被证实为有效的自噬抑制剂,尽管它们的调节机制各不相同。
其中,3-甲基腺嘌呤(3-MA)是一种广泛应用的自噬抑制剂,它通过抑制III类磷脂酰肌醇3-激酶(PI3K)的活性来阻断自噬体的形成,从而抑制自噬过程。另一种高选择性的不可逆PI3K抑制剂——渥曼青霉素,同样能够阻断自噬的发生,但其具体作用机制与3-MA有所不同。
除了上述抑制剂外,近年来还涌现出一系列新的小分子自噬抑制剂,如VPS34-IN1、SAR405和SB02024等。这些化合物通过调控VPS34(一种关键的PI3K家族成员)的活性来抑制自噬。VPS34在自噬体的形成过程中起着至关重要的作用,因此,通过抑制VPS34的活性可以有效地阻断自噬过程。
综上所述,自噬小分子抑制剂为研究和调控自噬过程提供了新的策略。这些抑制剂通过不同的机制抑制自噬,为深入探究自噬在疾病发生和发展中的作用提供了有力的工具。随着研究的不断深入,未来有望开发出更多具有高效、特异性的自噬抑制剂,为疾病治疗提供新的思路和方法。
结论
自噬作为维护细胞完整性和基因组稳定性的核心机制,其对人类疾病的根本生理重要性正随着研究的深入而日益凸显。当前,众多小分子化合物已被开发用于通过调节自噬来治疗人类疾病,特别是癌症。氯喹作为首个获得美国食品药品监督管理局(FDA)批准的自噬抑制剂,通过破坏溶酶体酸化来抑制自噬过程,标志着自噬调节药物研发的重要里程碑。
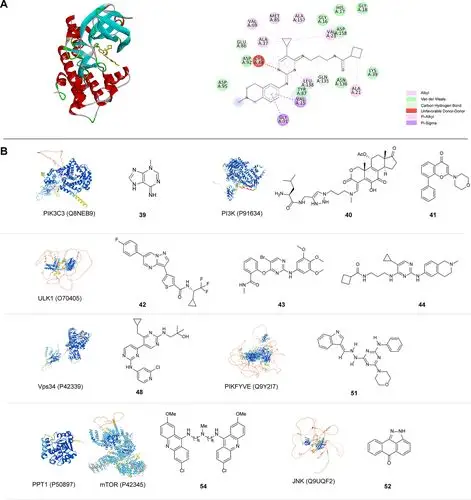
值得注意的是,众多小分子化合物通过靶向自噬相关蛋白激酶,如AMPK、ULK1和PI3K/AKT/mTOR等,在调节自噬过程中发挥着关键作用。这些蛋白激酶在自噬调控中不可或缺,因此成为药物研发的重要靶点。目前,已有多个小分子化合物,如19、21、34、37、43、44等,在调节自噬相关激酶方面取得了实质性进展,部分化合物甚至已进入药物临床前试验阶段。
然而,这一领域的探索仍面临诸多挑战与机遇。靶向耐药和脱靶耐药问题是开发自噬相关激酶调节剂的重要而长期的课题,这些问题可能由原蛋白靶点内的结构改变或代偿途径的异常激活或重新接线所致。
尽管在开发调节蛋白激酶的自噬激活剂或抑制剂方面存在诸多障碍和陷阱,但随着人工智能、快速高效的化合物筛选技术和图谱技术的飞速发展,这些关键瓶颈有望被逐步克服。生物信息学工具,如AlloDriver、AlloFinder和CavityPlus等,为设计具有潜力的小分子化合物提供了有力支持。此外,AlphaFold2数据集的最新进展能够更准确地预测蛋白质三维结构,为获得具有更好生理活性的蛋白激酶调节剂提供了可能。
综上所述,这些发现为发现更多候选小分子调节剂、激活或抑制自噬过程中更多的蛋白激酶提供了新线索,有望为未来的靶向治疗开辟新的道路。随着技术的不断进步和研究的深入,自噬调节药物的开发将迎来更加广阔的前景。
| 名称 | 货号 | 规格 |
| 凝乳蛋白酶(牛) | abs47047902-1g | 1g |
| 碱性蛋白酶 | abs47047498-1g | 1g |
| 中性蛋白酶 | abs47047496-250g | 250g |
| 胰蛋白酶(猪胰腺)1:250 | abs47014936-100g | 100g |






