Taurine Transporter Regulates Adipogenic Differentiation of Human Adipose-Derived Stem Cells through Affecting Wnt/β-catenin Signaling Pathway
一、引言
在肥胖及其相关疾病的研究中,人脂肪来源干细胞(human adipose-derived stem cells,简称hASCs)的成脂分化过程一直是科学家们关注的热点。这一过程不仅直接关系到脂肪组织的生成与积累,还与肥胖、糖尿病等多种代谢紊乱疾病的发生发展密切相关。近年来,越来越多的研究开始聚焦于探索调控hASCs成脂分化的分子机制,以期找到干预肥胖及相关疾病的新靶点。

二、研究背景与目的
随着生活水平的提高和饮食结构的改变,肥胖已成为全球范围内的重大公共卫生问题。肥胖不仅影响个体的外貌和自信心,更重要的是,它与多种慢性疾病如2型糖尿病、心血管疾病、高血压和某些癌症的风险增加密切相关。因此,寻找有效干预肥胖及相关疾病的方法显得尤为重要。
hASCs作为一类具有多向分化潜能的干细胞,在肥胖发生过程中扮演着重要角色。它们能够响应外界刺激,分化为成熟的脂肪细胞,从而增加脂肪组织的含量。因此,深入研究hASCs成脂分化的调控机制,对于理解肥胖的发病机制以及开发新的治疗策略具有重要意义。
TauT是一种负责牛磺酸及其相关化合物跨膜转运的膜蛋白,近年来被发现在多种生理和病理过程中发挥重要作用。特别是在肥胖和代谢综合征中,TauT的表达和活性变化与脂肪组织的生成和积累密切相关。然而,关于TauT如何具体调控hASCs成脂分化的机制尚不清楚。因此,本研究旨在通过深入探索TauT与Wnt/β-catenin信号通路之间的相互作用,揭示TauT在hASCs成脂分化过程中的具体作用机制,为肥胖及相关疾病的治疗提供新的思路。
三、研究方法与实验设计
为了深入探索TauT在hASCs成脂分化过程中的作用机制,研究人员采用了多种实验手段和技术,包括转录组测序、基因表达分析、细胞培养、分化诱导、流式细胞术、Western blotting、荧光显微镜观察以及动物实验等。具体研究方法和实验设计如下:
-
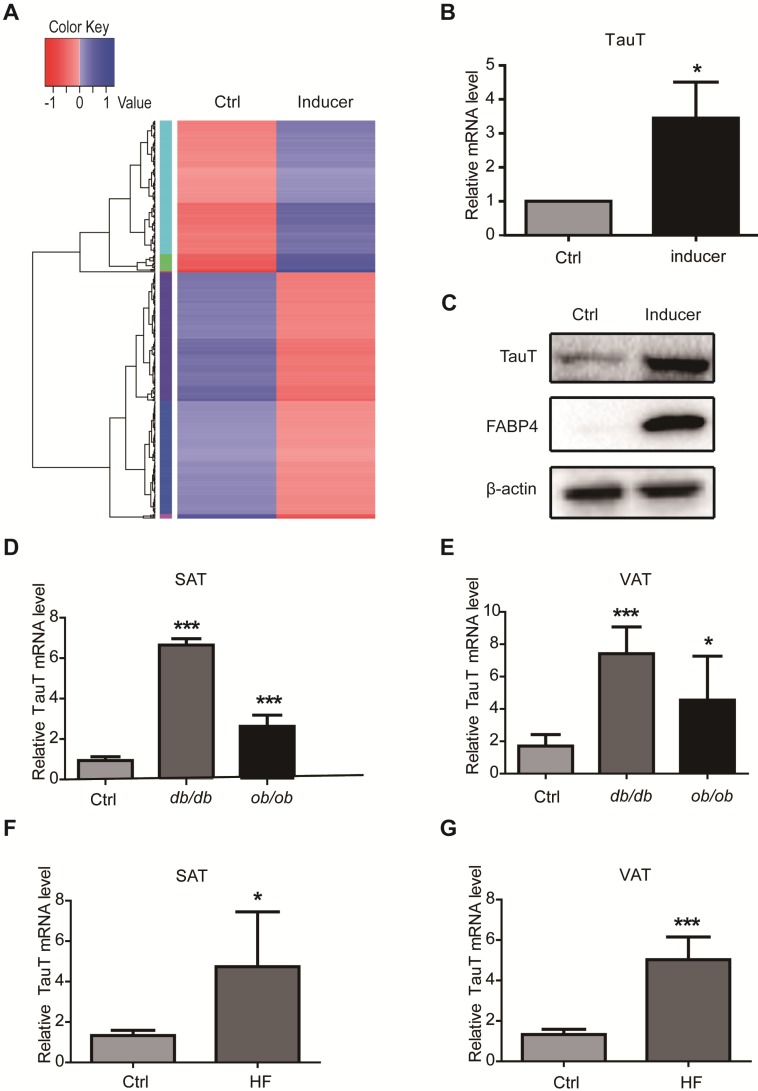
转录组测序与基因表达分析:首先,研究人员利用转录组测序技术,对处于不同分化阶段的hASCs进行基因表达谱分析,旨在找到与成脂分化相关的关键基因。通过比较不同分化阶段基因表达的变化,研究人员发现TauT的mRNA表达水平在hASCs分化过程中显著上调,提示TauT可能与hASCs的成脂分化密切相关。
-
细胞培养与分化诱导:接下来,研究人员利用hASCs进行细胞培养,并通过添加特定的分化诱导剂(如胰岛素、地塞米松、IBMX等)来诱导其向脂肪细胞分化。在分化过程中,研究人员分别设置了TauT过表达组、TauT敲低组以及对照组,以观察TauT对hASCs成脂分化的影响。
-
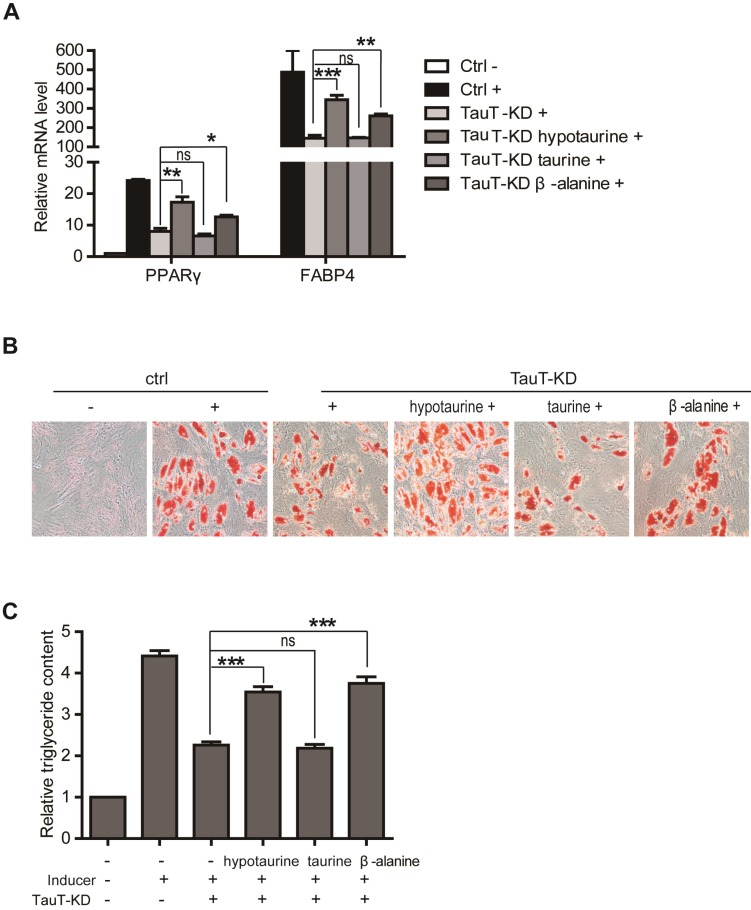
流式细胞术与Western blotting:为了验证TauT对hASCs成脂分化的影响,研究人员利用流式细胞术和Western blotting技术对分化后的细胞进行脂肪细胞特异性标记物(如FABP4、PPARγ等)的检测。结果显示,TauT过表达组细胞中的脂肪细胞特异性标记物表达水平显著高于对照组,而TauT敲低组则相反。这进一步证实了TauT对hASCs成脂分化的促进作用。
-
荧光显微镜观察:此外,研究人员还利用荧光显微镜观察了分化后细胞的形态变化。通过油红O染色等方法,可以直观地观察到脂肪细胞的形成和分布情况。结果显示,TauT过表达组细胞中的脂肪滴数量和大小均显著增加,而TauT敲低组则减少。这进一步支持了TauT在hASCs成脂分化过程中的重要作用。
-
Wnt/β-catenin信号通路分析:为了揭示TauT促进hASCs成脂分化的具体机制,研究人员进一步分析了Wnt/β-catenin信号通路的变化。通过检测β-catenin的蛋白水平和核定位情况,研究人员发现TauT过表达可以显著抑制β-catenin的蛋白表达和核定位,从而减弱Wnt/β-catenin信号通路的活性。而TauT敲低则相反,可以增强Wnt/β-catenin信号通路的活性。这提示TauT可能通过调控Wnt/β-catenin信号通路来影响hASCs的成脂分化。
-
动物实验验证:最后,为了验证上述发现是否在动物体内也具有同样的作用,研究人员利用高脂饮食诱导的肥胖小鼠模型进行了动物实验。通过检测小鼠脂肪组织中TauT和β-catenin的表达情况,以及脂肪细胞的形态和数量变化,研究人员发现TauT的表达水平与小鼠的肥胖程度密切相关。同时,通过敲低小鼠脂肪组织中的TauT表达,可以显著改善小鼠的肥胖表型。这进一步证实了TauT在肥胖发生过程中的重要作用。
四、研究结果与讨论
通过上述一系列实验,研究人员得出了以下重要结论:
-
TauT在hASCs成脂分化过程中发挥重要作用。通过上调TauT的表达水平,可以促进hASCs向脂肪细胞分化,增加脂肪组织的含量。这一发现为我们理解肥胖的发病机制提供了新的视角。
-
TauT通过调控Wnt/β-catenin信号通路来影响hASCs的成脂分化。具体而言,TauT可以抑制β-catenin的蛋白表达和核定位,从而减弱Wnt/β-catenin信号通路的活性。这一发现揭示了TauT促进hASCs成脂分化的具体机制。
-
动物实验结果进一步证实了上述发现。通过敲低肥胖小鼠脂肪组织中的TauT表达,可以显著改善小鼠的肥胖表型。这一发现为我们开发针对肥胖及相关疾病的新治疗策略提供了重要依据。
在讨论部分,研究人员还指出了一些值得进一步探讨的问题。例如,TauT如何精确调控Wnt/β-catenin信号通路的活性?是否还有其他信号通路或分子参与TauT对hASCs成脂分化的调控?这些问题的解答将有助于我们更全面地理解肥胖的分子机制,并为开发更有效的治疗策略提供新的思路。
五、结论与展望
综上所述,本研究通过深入探索TauT在hASCs成脂分化过程中的作用机制,揭示了TauT通过调控Wnt/β-catenin信号通路来促进hASCs向脂肪细胞分化的新机制。这一发现不仅为我们理解肥胖的发病机制提供了新的视角,也为开发针对肥胖及相关疾病的新治疗策略提供了重要依据。
展望未来,随着对肥胖及其相关疾病分子机制的深入研究,我们有望发现更多与肥胖相关的关键基因和信号通路。通过精准干预这些基因和信号通路,我们可以更有效地预防和治疗肥胖及相关疾病,为人类的健康事业做出更大的贡献。同时,我们也期待未来能有更多的研究者加入到这一领域中来,共同推动肥胖及其相关疾病研究的深入发展。
| 名称 | 货号 | 规格 |
| Rabbit anti-τT Polyclonal Antibody | abs140562-50ug | 50ug |
| PPARgamma (81B8) Rabbit mAb | 2443T | 20μl |
| PPARgamma (81B8) Rabbit mAb | 2443S | 100ul |
| α Tubulin (AA12) | sc-58667 | 200μg/ml |







