Spatial transcriptomics reveal neuron-astrocyte synergy in long-term memory
引言
长期记忆的形成是大脑编码、存储与检索过往经验的核心机制,对于个体规划未来行为具有不可替代的重要性。杏仁体(特别是其基底外侧部分,即basolateral amygdala, BLA)作为情绪体验的关键中枢,在情绪性记忆,尤其是长期恐惧记忆的形成过程中发挥着至关重要的作用。
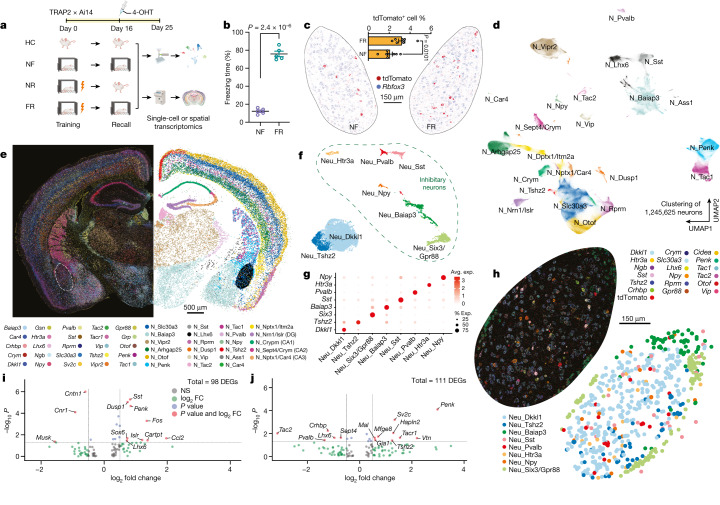
近日,一项发表于《Nature》杂志上的研究——“Spatial transcriptomics reveal neuron–astrocyte synergy in long-term memory”通过采用高分辨率的空间和单细胞转录组学分析技术,深入探讨了BLA在长期记忆形成过程中的分子与细胞机制。该研究不仅揭示了特定亚群的神经元和星形胶质细胞在记忆形成阶段展现出的独特转录特征,而且这些特征能够持续数周之久,涵盖了神经肽(neuropeptide)和脑源性神经营养因子(BDNF)信号传导、MAPK和CREB信号通路激活、泛素化途径(ubiquitination pathways)调控以及突触连通性(synaptic connectivity)重塑等关键分子机制。
尤为重要的是,研究发现了一种由增加Penk表达与降低Tac表达所定义的神经元亚群,这些神经元构成了BLA记忆痕迹(memory engram)的核心组成部分。这一转录变化不仅通过单细胞RNA测序技术得到了验证,还通过单分子空间转录组学技术在完整的组织切片中实现了丰富的空间映射,为记忆痕迹提供了详尽的空间图谱。
此外,空间数据进一步揭示了这些神经元亚群与相邻星形胶质细胞之间的复杂相互作用。功能实验进一步证实,神经元与星形胶质细胞之间的这种相互作用对于编码长期记忆具有至关重要的意义。通过将当前研究结果与先前数据集进行整合分析,研究者们得以探究大脑不同区域在长期恐惧记忆中展现出的区域特异性与普遍性的基因表达变化模式。
综上所述,这项研究不仅极大地深化了我们对长期记忆形成机制的理解,还为未来针对记忆相关疾病的治疗策略提供了潜在的分子靶点,具有重要的理论意义与临床应用前景。

神经元与星形胶质细胞的协同作用研究新进展
本研究揭示了长期记忆形成过程中,特定亚群神经元与星形胶质细胞之间的协同作用机制。这一发现突破了传统仅聚焦神经元角色的研究框架,强调了星形胶质细胞在记忆形成过程中的重要积极作用。通过综合运用空间转录组学与单细胞转录组学技术,本研究提供了记忆痕迹在分子和细胞层面的高分辨率图谱。这种高精度的分析方法不仅揭示了细胞间复杂的相互作用和转录动态变化,还为深入理解记忆形成的细胞和分子机制提供了全新视角。
进一步地,本研究利用单分子空间转录组学技术,为参与长期记忆的特定神经元和星形胶质细胞亚群提供了详尽的空间映射。这些空间数据使得研究者能够在组织层面上精确定位记忆相关的细胞和基因表达模式,为记忆研究提供了更为直观和全面的理解。
此外,本研究还发现了多个与长期记忆形成密切相关的关键分子路径,包括神经肽信号传导、脑源性神经营养因子(BDNF)信号通路、MAPK和CREB的激活以及突触连通性等。这些分子机制的揭示,为进一步探究记忆形成的生物学基础以及开发相关神经疾病的治疗策略提供了重要线索和理论依据。
最后,通过与先前数据的整合分析,本研究还发现不同大脑区域在长期恐惧记忆中使用了相似的分子程序和细胞类型,揭示了跨大脑区域的记忆机制一致性。这一发现加深了我们对记忆网络如何在大脑内协调工作以形成和存储记忆的理解,为记忆研究领域提供了新的思路和方向。
空间转录组学、单细胞转录组学、基因编辑及行为学实验在记忆研究中的应用
空间转录组学(Spatial Transcriptomics)技术被应用于组织切片层面,以测定基因的空间表达模式,为记忆痕迹提供详尽的空间分布图谱。该技术通过对固定的大脑切片进行高通量的基因表达分析,能够在保持细胞原有空间位置的前提下,同时测定数千个基因的表达水平,从而揭示特定神经元亚群与其相邻星形胶质细胞之间的空间相互作用模式。
单细胞转录组学(Single-Cell Transcriptomics)技术则通过单细胞RNA测序,深入分析单个细胞的基因表达情况,揭示神经元和星形胶质细胞在分子层面的异质性以及记忆特异性的转录特征。该技术首先将单个细胞分离并提取其RNA,经过逆转录和扩增后,利用高通量测序技术全面分析其基因表达谱,进而识别出参与长期记忆的特定细胞亚群及其转录活动。
基因编辑(Gene Editing)技术,如CRISPR/Cas9系统,被用于验证特定基因在记忆形成中的功能和作用。通过选择与长期记忆形成密切相关的目标基因,利用CRISPR/Cas9系统对这些基因进行精确敲除或敲降,随后通过行为学和分子生物学实验,系统评估这些基因编辑操作对记忆形成的具体影响。
行为学实验(Behavioral Experiments)则通过一系列经典测试,如恐惧条件化实验,来评估长期记忆的形成以及基因编辑后对记忆功能的影响。通过对比野生型小鼠和基因编辑后小鼠的行为表现,可以深入探究特定基因在记忆过程中的具体作用。
最后,将空间转录组学和单细胞转录组学数据进行整合分析(Integrated Analysis),利用生物信息学工具,全面揭示长期记忆过程中的细胞类型特异性和区域特异性基因表达模式。通过这一综合分析,可以识别出记忆过程中的关键基因和信号通路,以及它们在不同细胞类型和大脑区域中的分布和具体作用,为深入理解记忆机制提供有力支持。
记忆研究的新进展
本研究揭示了长期恐惧记忆形成过程中,特定亚群神经元和星形胶质细胞所展现出的记忆特异性持续转录特征。这些特征涵盖了神经肽和脑源性神经营养因子(Brain-Derived Neurotrophic Factor, BDNF)信号传导、丝裂原活化蛋白激酶(Mitogen-Activated Protein Kinase, MAPK)和cAMP反应元件结合蛋白(CAMP Response Element-Binding Protein, CREB)的激活、泛素化途径以及突触连接性等关键组分,为理解记忆形成的分子基础提供了重要线索。
通过单分子空间转录组学技术,本研究成功绘制了记忆痕迹的空间图谱,精确展示了特定神经元亚群与相邻星形胶质细胞之间的空间相互作用模式,为记忆痕迹的组织定位提供了直观证据。
空间数据进一步揭示了记忆形成时特定神经元亚群与相邻星形胶质细胞之间的紧密互动。功能实验结果表明,神经元与星形胶质细胞的相互作用对于长期记忆的编码至关重要,强调了两者在记忆形成过程中的协同作用。单细胞转录组学分析识别了与长期记忆形成密切相关的分子机制,其中包括在特定神经元亚群中观察到的Penk基因表达增加和Tac基因表达降低等关键变化,为深入探究记忆形成的分子调控网络提供了新视角。
通过与先前数据集的整合分析,本研究发现不同大脑区域在长期恐惧记忆中使用了相似的分子程序和细胞类型,表明长期记忆的形成和存储可能依赖于大脑内不同区域间的协调作用,加深了我们对记忆网络整体运作机制的理解。此外,实验还进一步证明了星形胶质细胞在记忆形成中的积极作用。通过基因编辑技术抑制星形胶质细胞的激活,导致记忆形成能力显著下降,这一结果强有力地支持了星形胶质细胞在调节神经元功能和促进记忆形成中的关键角色。
展望
关于具体的分子通路如何调节记忆形成,尽管当前研究已识别出多个与长期记忆形成密切相关的关键分子和信号通路,如神经肽、脑源性神经营养因子(BDNF)信号、MAPK和CREB激活等,然而,这些分子和信号通路在细胞内如何相互交织、共同调控记忆形成的详细作用机制,仍需进一步深入探究。
星形胶质细胞如何精确调控神经元功能的问题同样亟待解决。现有研究表明,星形胶质细胞在记忆形成过程中扮演着至关重要的角色,但它们如何特异性地影响特定神经元亚群的功能,以及如何精确调节神经信号传递和突触可塑性,其具体机制仍不完全明了。
记忆痕迹的长期稳定性机制也是一个值得深入探讨的课题。尽管研究已揭示了记忆痕迹的空间映射和转录特征,但记忆痕迹如何在长时间内保持稳定,以及支撑记忆长期存储的分子和结构基础,仍是当前研究中的开放问题。此外,不同大脑区域间如何协同工作以形成一致的记忆,也是未来研究的重要方向。研究发现,不同大脑区域在形成长期记忆时存在一致的分子机制,但这些区域如何相互协调配合,以及信息如何在这些区域间有效传递以形成完整的记忆网络,仍需更深入的研究来揭示。
记忆形成与遗忘的平衡调节机制同样值得关注。记忆的形成和遗忘是大脑信息处理的两个核心方面,当前研究主要集中于记忆形成的机制,而遗忘过程中的相应分子和细胞机制,以及如何平衡记忆的稳定性与可塑性,仍是亟待探索的领域。最后,如何将这些基础科学发现转化为治疗记忆障碍的具体策略,也是当前面临的一大挑战。研究为理解记忆形成提供了新的分子靶点,但如何将这些靶点转化为有效的治疗手段,以应对阿尔茨海默病等记忆障碍疾病,仍需科研工作者们的不懈努力和探索。
| 名称 | 货号 | 规格 |
| Papain Dissociation System | LK003150 | 1bx |
| Papain Dissociation System | LK003153 | 3bx |
| MCHERRY RAT MONOCLONALANTIBODY | M11217 | 100UL |
| c-Fos | 226308 | 50ug |







