线粒体功能多维检测工具箱:膜电位、质量及ROS荧光探针谱系与性能比较
线粒体作为细胞能量代谢的核心枢纽,在活性氧(ROS)信号调控、能量代谢稳态维持及生物大分子合成网络中发挥多重关键作用。其不仅作为ATP合成的主要场所和钙离子稳态调节器,更通过三羧酸循环、脂肪酸氧化等途径深度参与氨基酸、脂类及核苷酸的生物合成过程,构成细胞代谢重构的核心调控节点。
线粒体网络呈现显著的细胞类型特异性形态可塑性,其数量、体积及超微结构特征严格遵循细胞代谢需求进行动态调整。鉴于其在细胞存活与功能执行中的核心地位,线粒体功能障碍已成为多种病理状态的显著标志,广泛存在于遗传性代谢疾病、神经退行性病变、恶性肿瘤发生及衰老相关退变过程中。此类功能障碍的分子表型通常表现为线粒体膜电位(mtΔΨ)去极化、线粒体质量异常调控以及氧化还原平衡紊乱等特征性改变。
流式细胞术为线粒体功能分析提供了独特的单细胞分辨率检测平台,可实现完整细胞环境下多参数同步监测,有效规避线粒体分离操作或细胞膜透化处理可能引入的实验偏差。当前已开发多种线粒体靶向性荧光探针工具(如表1所示),可针对线粒体膜电位、蛋白质质量控制及氧化应激水平等关键功能参数进行定量检测,为解析线粒体功能障碍的分子机制及疾病干预研究提供了重要的技术支撑。
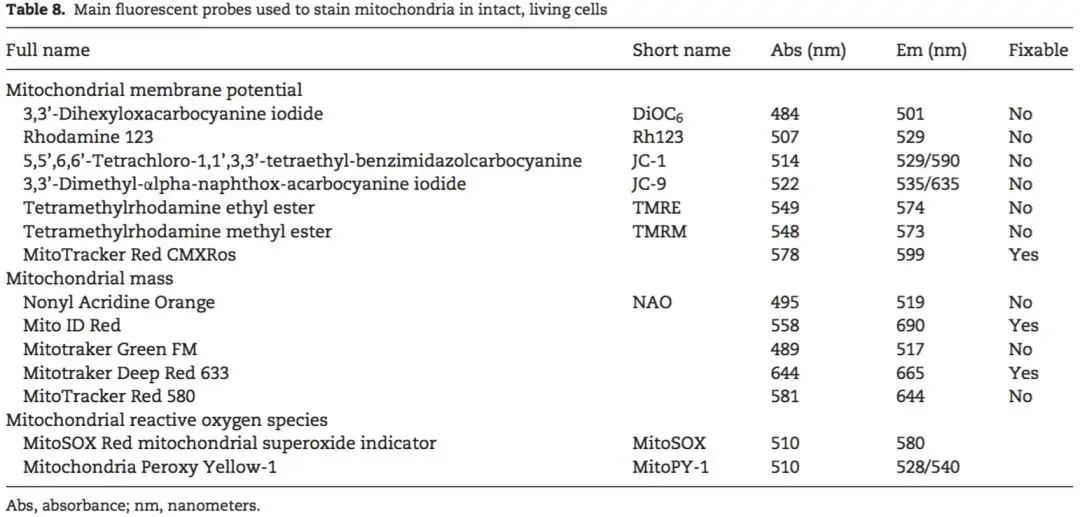
线粒体膜电位(mtΔΨ)作为质子动力势的核心组成部分,由线粒体内膜两侧质子梯度形成,其动态变化直接反映线粒体功能状态与ATP合成效能,已成为评估细胞能量代谢健康的关键生物标志物。线粒体基质因维持负电位环境,为亲脂性阳离子荧光探针提供了作用靶点——这类带正电荷的分子可跨膜自由扩散,并根据膜电位梯度在线粒体基质中发生选择性富集,其积累量与mtΔΨ强度呈严格正相关关系。超极化线粒体因电化学梯度增强可蓄积更多探针分子,而去极化状态则导致探针滞留量显著减少。
在流式细胞术检测体系中,需严格遵循两大技术要点以确保检测精度:
1. 染料浓度优化与淬灭控制
需通过梯度滴定实验确定最佳工作浓度。高浓度染料易引发自淬灭效应,导致荧光信号与膜电位变化脱钩。经验数据显示,将染料终浓度控制在1-30 nM区间可有效规避该现象,同时需注意不同探针间存在特异性浓度阈值差异。
2. 功能性对照体系的构建
必须设置标准化对照实验以实现信号解读的生物学归一化,推荐对照包括:
- 去极化诱导组:FCCP、CCCP(质子载体)及valinomycin(钾离子载体)通过解偶联呼吸链诱导膜电位崩解;
- 代谢抑制组:oligomycin作为ATP合成酶抑制剂可阻断质子回流,引发继发性膜电位下降;
- 超极化诱导组:nigericin(K+/H+离子载体)通过调节pH梯度诱导膜电位超极化。
常用线粒体膜电位探针特性分析
| 探针名称 | 优势特性 | 局限性及注意事项 |
|---|---|---|
| DiOC6 | 早期流式应用广泛,细胞渗透迅速 | 存在NADH抑制活性,具有线粒体毒性,长期使用需谨慎评估细胞存活率 |
| 罗丹明123 | 细胞负载快速,平衡时间短 | 亚线粒体定位不稳定,部分结合事件与能量状态无关,定量分析需谨慎验证 |
| TMRE/TMRM | 无细胞毒性,光稳定性优异 | 需严格控制在低浓度使用(建议≤10 nM),适合即时检测无需洗涤流程,但需设置未染色样品作为背景荧光基线校正 |
实际应用中,TMRE/TMRM因其优异的信号稳定性成为首选工具,其检测信号通常以平均荧光强度(MdFI)变化作为mtΔΨ动态变化的定量指标。通过结合功能性对照与多参数流式面板设计,可实现线粒体功能异常与细胞凋亡、代谢重编程等病理过程的精准关联分析。

碳氰染料家族中的JC-1已被确立为线粒体膜电位(mtΔΨ)检测领域的金标准探针,其独特的双色荧光发射特性支持对线粒体功能状态进行比率型半定量解析。在单体形式下,JC-1呈现绿色荧光发射峰(λ_em=529 nm),而当线粒体处于高极化状态时,该探针可在mtΔΨ驱动下形成J-聚集体,触发显著的红移荧光信号(λ_em>590 nm)。这种光谱特性转换机制使得JC-1成为监测线粒体膜电位动态变化的理想工具:在代谢活跃的健康细胞中,线粒体网络呈现以橙红色荧光为主的特征性分布;而当线粒体膜电位崩溃时(如药物诱导去极化),JC-1立即解聚为单体形式,导致绿色荧光信号占比显著增加。
值得注意的是,JC-1的荧光信号解读需遵循特定的数据呈现规范。虽然传统分析常采用红绿荧光强度比值(Ratiometric Analysis),但现代研究更推荐采用细胞群体分层策略——即分别统计高mtΔΨ(橙红色主导)与低mtΔΨ(绿色主导)细胞的百分比构成。这种分析框架可有效规避仪器灵敏度波动、细胞自发荧光差异等混杂因素,更精准地反映线粒体功能异质性在疾病模型或药物干预下的动态演变规律。实验设计时应特别注意设置FCCP/oligomycin诱导的阳性对照,以建立可靠的信号解读基准。

自1993年首次报道以来,JC-1已确立为跨细胞类型与检测体系的线粒体膜电位(mtΔΨ)检测金标准,其与多色荧光探针方案的兼容性亦通过大量实验验证。该探针存在单体(绿色荧光,λ_ex/em=529 nm)与J-聚集体(橙红色荧光,λ_ex/em>590 nm)两种互变异构形式,其比例变化直接反映线粒体极化状态。健康细胞中,线粒体网络呈现以橙红色荧光为主的特征性分布;当线粒体膜电位崩溃时(如药物诱导去极化),JC-1立即解聚为单体形式,导致绿色荧光信号占比显著增加。尽管如此,JC-1的应用仍受限于其对过氧化氢的氧化敏感性、光漂白倾向以及较慢的平衡动力学特性。JC-9(λ_ex=522 nm,单体/聚集体发射分别为535 nm/635 nm)与JC-10(λ_ex=490 nm,单体/聚集体发射分别为520 nm/590 nm)作为结构类似物,在光谱特性上提供替代选择。
线粒体质量检测策略聚焦于特异性结合线粒体成分的荧光探针,其荧光强度与线粒体含量呈严格正相关。Mito ID与诺香豆素橙(NAO)通过靶向心磷脂实现内膜特异性标记,而MitoTracker系列染料则与线粒体蛋白的巯基基团(如半胱氨酸残基)发生共价结合。其中,MitoTracker Deep Red 633因具备醛基固定兼容性,尤其适用于细胞周期与线粒体动力学的关联研究。此类探针的信号解读需遵循与TMRE/TMRM相同的分析规范,即通过平均荧光强度(MdFI)变化量化线粒体质量动态。
针对线粒体活性氧(mtROS)检测,MitoSOX与mitoPY1构成互补性工具组合:MitoSOX作为氢乙啶类衍生物,依赖mtΔΨ在线粒体基质富集,经超氧化物氧化后与mtDNA结合产生红色荧光(λ_ex/em=510/580 nm);mitoPY1则通过硼酸酯基团特异性捕获过氧化氢,触发绿色荧光信号(λ_ex/em=490/520 nm)。验证实验需构建双重对照体系:对于MitoSOX,阳性对照采用抗霉素A或阿霉素诱导超氧化物爆发,阴性对照使用细胞渗透性超氧化物歧化酶模拟物(如TEMPOL)或线粒体解偶联剂(如FCCP);对于mitoPY1,则以外源H2O2作为阳性对照,N-乙酰半胱氨酸(NAC)作为阴性对照。多篇研究已验证这两种探针在角质形成细胞、内皮细胞、成纤维细胞及多种肿瘤细胞系中的检测特异性,并实现MitoSOX与mitoPY1的共染色方案,为活细胞mtROS亚型分析提供了多维检测平台。
| 名称 | 货号 | 规格 |
| 线粒体膜电位检测试剂盒(JC-10) | abs50017-100T | 100T |
| 线粒体膜电位检测试剂盒(JC-1) | abs50016-100T | 100T |
| 荧光钙探针 Fura 2-AM | abs42018799-1mg | 1mg |
| 荧光钙探针 Fura 2-AM | abs42018799-1mg | 1mg |







