染色体断裂及其异常片段重排构成了染色体结构变异的分子病理学基础,其典型类型涵盖缺失/插入、倒位、易位及重复等变异形式。染色体结构改变的致病机制主要体现为两类:一是剂量敏感基因发生拷贝数异常(缺失或扩增),二是染色体断裂位点破坏基因组功能元件,通过干扰基因表达调控或损害蛋白质功能引发病理改变。

在各类染色体结构变异中,复杂染色体重排(CCR)的检测最具挑战性,其定义为涉及三条及以上染色体、包含三个或更多断裂点的染色体片段异常重组。根据重排模式与复杂程度,Kausch团队将CCR划分为三类亚型:
1)三方重排(three-way CCR):三条染色体各发生一次断裂并形成三向片段交换;
2)双重重排(double two-way CCR):两个或三个独立染色体易位事件共存;
3)特殊CCR(exceptional CCR):染色体呈现多断裂点复杂重组,衍生出多条异常染色体。
复杂染色体重排携带者常表现为神经发育障碍和/或先天畸形,即使表型正常个体亦可能面临生育障碍(不孕不育、复发性流产)及子代畸形风险。表型异常风险与受累染色体数目及断裂点总量呈显著正相关,凸显精准检测此类变异对遗传病诊断、治疗决策、预后评估及遗传咨询的关键价值。
当前CCR检测需联合核型分析、染色体微阵列分析(CMA)、荧光原位杂交(FISH)等多技术平台,但存在检测周期长、流程复杂、结果解析困难及人力成本高等局限性。山东省妇幼保健院医学遗传与产前诊断中心开展的研究中,纳入7例确诊携带复杂染色体结构变异(至少含两个断裂点)的患者,系统评估全基因组光学图谱(OGM)技术对染色体结构变异及断裂点(BP)的检测效能,并与标准检测方案进行结果比对。研究同步采用单管长片段读取(stLFR)技术构建文库进行二代测序(NGS),并结合Sanger测序对关键断裂点位置及片段连接方式进行验证。
研究证实,在CCR检测领域,OGM技术相较传统核型分析与CMA展现出更优的检测性能与临床应用前景:
- OGM可单次检测同步完成染色体结构变异解析与拷贝数变异分析,其检测结果与核型-CMA联合方案具有高度一致性;
- 针对CMA无法识别的平衡性结构变异及核型分析易漏检的隐匿性染色体易位/倒位,OGM表现出显著检测优势;
- 在超复杂染色体重排样本中,OGM可精准判定扩增片段的插入方向与定位信息,为评估变异事件对基因功能的潜在影响提供关键证据。
样本特征
研究共纳入7例受试者,所有病例均通过核型分析联合染色体微阵列分析(CMA)及荧光原位杂交(FISH)技术,明确检出携带平衡性或非平衡性染色体片段重排的核型异常。受试者临床表型与染色体结构变异特征详列于表1,其中1-3号病例为表型正常但存在生育障碍或不良孕产史的育龄期成人;4-7号病例为表现为发育迟缓合并/不合并智力异常的儿科患者。
OGM在复杂染色体重排及断裂点(BP)检测中的验证结果分析
光学基因组图谱(OGM)技术实现了染色体结构变异(SV)与拷贝数变异(CNV)的同步分析。通过对7例临床样本的核型分析(karyotyping)及染色体微阵列分析(CMA)结果比对,证实OGM与标准检测技术呈现高度一致性(表1)。值得注意的是,在断裂点(BP)检测存在差异的案例中,OGM未能识别的变异区域均定位于近着丝粒区域(pericentromeric regions),包括22p12、9p11及9p13,推测该区域因高度重复序列特征限制了短读长测序技术的解析能力。
在复杂染色体重排(CCR)病例中,OGM展现出显著优势:除复现核型分析结果外,还额外检出CMA无法识别的平衡性结构变异(balanced structural variations),并揭示了核型分析漏检的隐匿性易位(cryptic translocations)及倒位(inversions)。进一步分析表明,OGM可精准定位重排片段的插入方向(orientation)及基因组坐标,为评估变异事件对基因功能的潜在影响提供了关键证据。例如,在平衡性重排案例中,OGM通过断点序列解析明确了重排是否导致基因融合或调控元件错配,从而补充了传统技术仅能检测拷贝数变化的局限性。
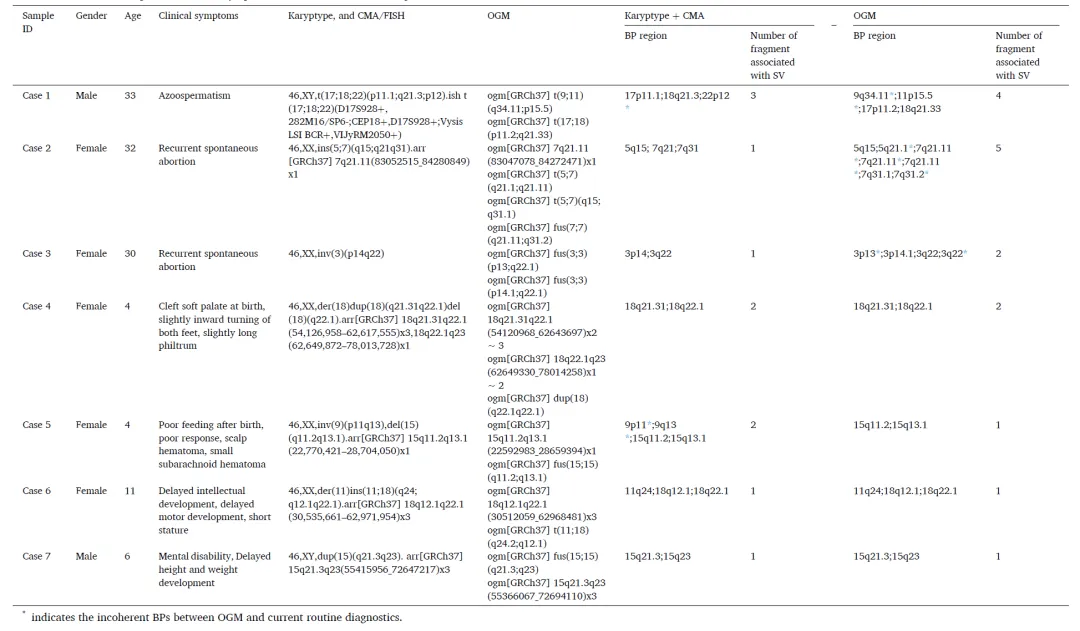
病例1:非梗阻性无精子症患者(33岁)
核型分析提示三向易位(three-way translocation)t(17;18;22)(p11.1;q21.3;p12),荧光原位杂交(FISH)验证了该复杂重排(图A、B)。OGM进一步发现一例隐匿性易位t(9;11)(q34.11;p15.5),其中9号染色体易位片段跨度8Mb(BP: chr9:132.154-132.173 Mb),11号染色体对应片段长度为1Mb(BP: chr11:1.259-1.287 Mb)(图C)。该易位直接导致MUC5B基因编码区断裂(图D),经FISH验证后,研究者构建了包含断点序列及重排拓扑结构的基因组重组模型(图E)。此案例凸显OGM在解析低拷贝重复序列介导的复杂重排中的技术优势,其单分子分辨率特性为评估隐性基因组损伤提供了传统细胞遗传学手段难以企及的细节。
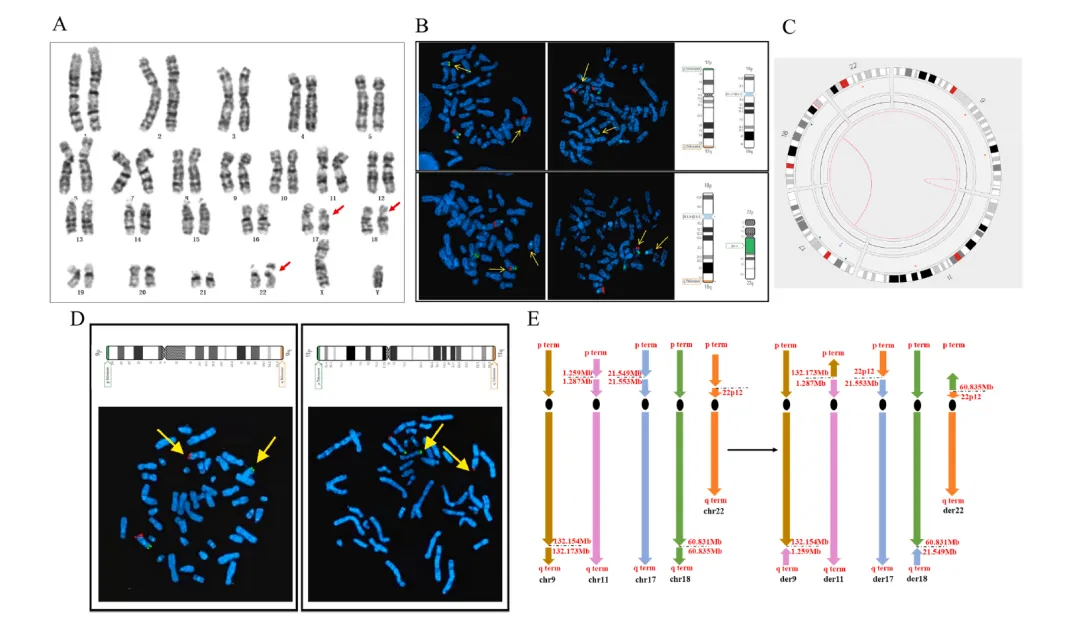
病例2涉及一名32岁健康育龄女性,其妊娠史包括两次因胎儿先天性畸形行引产术(首胎为多囊肾,次胎为唇腭裂)。核型分析揭示7号染色体q21-q31区段插入至5号染色体q15区域(图A),形成5q15单一断裂点及7q21、7q31双断裂点。染色体微阵列分析(CMA)进一步检测到7号染色体长臂存在约1.2 Mb的拷贝数缺失(GRCh37: 83,052,515-84,280,849)(图B)。
光学基因组图谱技术(OGM)解析出5号与7号染色体间发生两处相互易位:t(5;7)(q15;q31.1)及t(5;7)(q21.1;q21.11),同时鉴定出7号染色体内部复杂重排事件——fus(7;7)(q21.1;q31.2)(图C)。该技术精确界定7号及5号染色体共7个断点坐标(chr7:81.719-81.720 Mb、83.047 Mb、84.273 Mb、111.765-111.771 Mb、114.961-114.972 Mb;chr5:95.259-95.265 Mb、101.102-101.118 Mb)(图D)。
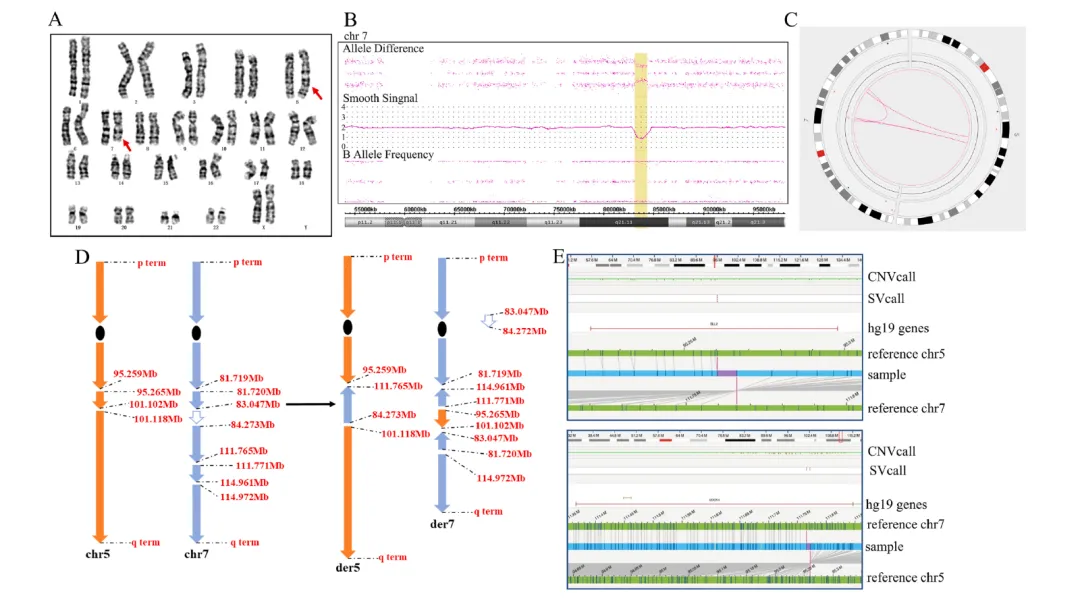
针对CMA提示的拷贝数缺失区域,OGM通过高分辨率断点解析发现:chr7:83.719-83.047 Mb与chr7:111.771-114.961 Mb区段经倒位后发生相互易位,并整合来自chr5:95.265-101.102 Mb的插入片段。此重排事件导致CACNA2D1和SEMA3E基因功能失活,同时在衍生染色体5、7上形成ELL2::DOCK4融合基因(图E)。在非平衡性复杂重排解析中,OGM相较于传统技术凸显独特优势:除验证CMA检测的拷贝数变异及断点定位外,更可精准判定重排片段的插入方位与空间构象。例如,病例4中检测到反向串联重复结构(图A),病例7样本呈现7号染色体直接串联重复(图D),而病例6则显示18q12.1q22.1(30,512,059-62,968,481)区段重复拷贝插入至11q24区域(125.490-125.502 Mb)(图C)。
研究表明,在解析复杂染色体重排机制方面,光学基因组图谱技术(OGM)相较于传统核型分析(Karyotyping)及染色体微阵列分析(CMA),展现出显著更高的分辨率及临床转化价值。本研究证实,通过单一OGM检测流程即可实现染色体结构变异(SVs)与拷贝数变异(CNVs)的同步解析,并精准定位断裂点相关基因功能损伤事件。该技术不仅在变异检出效能与解析精度层面具有显著优势,更可替代传统序贯式检测策略,实现诊断时效性的大幅提升。
值得注意的是,OGM的检测局限性主要体现为:对重复序列高度富集的间隙区域(如近着丝粒异染色质区)染色体变异解析能力不足。针对此类遗传学复杂区域,建议联合核型分析进行补充验证,以构建更完备的染色体变异检测体系。
关于Bionano
Bionano Genomics是一家专注于基因组学分析领域的生命科学仪器研发企业,其核心产品Saphyr系统作为新一代超灵敏结构变异检测平台,通过纳米级分辨率的基因组图谱分析技术,为疾病机制研究及临床转化应用提供了革新性解决方案。该平台整合了仪器、芯片耗材、试剂套装及分析软件,构建了从样本处理到数据解析的完整工作流程,显著提升了基因组结构变异检测的通量、精度与可重复性,推动了数字细胞遗传学检测向标准化、自动化方向演进。
关于Saphyr
Saphyr系统基于单分子光学图谱技术,可实现100kbp至Mbp级长读长的高通量分析,在基因组结构变异检测领域展现出卓越性能。其技术优势体现在:1)全基因组覆盖度突破传统细胞遗传学技术局限,对染色体易位、倒位等复杂结构变异实现单碱基分辨率解析;2)检测灵敏度较核型分析(Karyotyping)和荧光原位杂交(FISH)提升2-3个数量级;3)集成超过120,000个纳米通道阵列的半导体芯片,配合高动态范围CCD成像模块,单次运行可捕获5TB级原始数据;4)配套生物信息学工具通过专利算法将光学信号转化为高精度分子标记图谱,实现结构变异的自动化识别与可视化呈现。
在临床研究场景中,该系统已广泛应用于肿瘤遗传学、血液恶性疾病、孟德尔遗传病及罕见病等领域,成功解析了传统技术难以检测的平衡易位、复杂重排等变异类型。在基因组从头组装(de novo assembly)应用中,Saphyr通过提供超长连续 scaffold 骨架,显著提升了真核生物基因组组装的完整性和相位准确性,为进化生物学、功能基因组学研究提供了关键技术支持。其技术体系代表了基因组结构分析领域向高维度、多组学整合方向发展的重要突破。
| 名称 | 货号 | 规格 |
| Soyasaponin Bd | abs47012713-5mg | 5mg |
| rHuLeptin BD | abs44075284-10ug | 10ug |
| BD-5 Protein, Human | UA040328-1mg | 1mg |
| BD-2 Protein, Mouse | KIT-HP- UA040327-1mg | 1mg |







