Durability of antibody response to vaccination and surrogate neutralization of emerging variants based on SARS-CoV-2 exposure history
研究背景与目的
严重急性呼吸综合征冠状病毒2(SARS-CoV-2)引发了全球性新冠疫情。为应对疫情,辉瑞(BNT162b2)和莫德纳(mRNA-1273)等mRNA疫苗被迅速开发并广泛应用。临床数据表明,这些疫苗在预防有症状感染方面具有高效力。然而,疫苗诱导的免疫应答的持久性仍不明确,尤其是在新出现的病毒变异株(如B.1.1.7、B.1.351、P.1)面前,疫苗的保护效力是否持续存在,成为公共卫生关注的焦点。
此外,个体在接种疫苗前的SARS-CoV-2暴露史是否会影响疫苗免疫应答的强度和持久性,亦尚缺乏系统研究。为回答上述问题,McDade等人开展了一项社区血清学研究,系统评估了mRNA疫苗接种后抗体应答的动态变化,并分析了对多种变异株的替代中和能力,以及不同暴露史背景下免疫应答的差异。
研究设计与方法
该研究基于一项已开展的社区血清流行病学研究(SCAN),共纳入27名参与者,平均年龄为39.7岁,女性占51.9%。其中,59.3%接种了辉瑞疫苗,40.7%接种了莫德纳疫苗。根据接种前的SARS-CoV-2暴露情况,参与者被分为三组:
PCR阳性组(n=4):曾确诊COVID-19;
血清阳性组(n=9):未确诊但体内存在抗RBD IgG抗体;
血清阴性组(n=14):无既往感染证据。
研究采集了接种第一剂疫苗后平均18.5天、第二剂后平均20.7天及接种后约3个月(平均95.5天)的血液样本。采用干血点(DBS)采样法,通过定量免疫分析法检测抗RBD IgG抗体浓度,并使用替代病毒中和试验(sVNT)评估对野生型(Wuhan)及三种变异株(B.1.1.7、B.1.351、P.1)的中和能力。
抗体应答的动态变化
抗体浓度的变化趋势
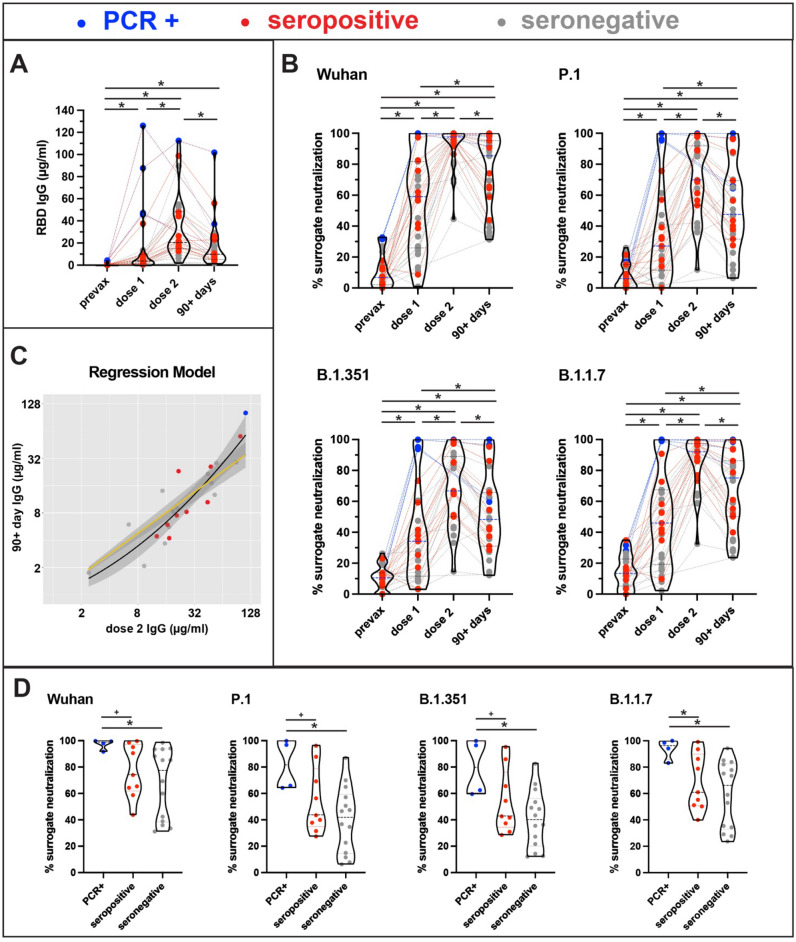
研究结果显示,接种第二剂疫苗后,抗RBD IgG抗体浓度显著升高,中位数从第一剂后的4.2 μg/mL上升至21.0 μg/mL,增幅达5倍(图1A)。然而,在接种后约3个月时,抗体浓度平均下降50.1%,中位数降至10.5 μg/mL。回归分析表明,第二剂后的抗体水平对3个月后的抗体浓度具有高度预测性(R² = 0.839,p < 0.0001),提示初始免疫应答强度与持久性密切相关。
中和能力的变化趋势
在替代中和试验中,第二剂疫苗后对野生型病毒的中和抑制率中位数为97.7%,显著高于第一剂后的59.1%。然而,对变异株的中和能力普遍较低,尤其是P.1和B.1.351株,第二剂后的抑制率分别为70.0%和66.7%。在3个月后,所有变异株的中和能力均出现下降,其中P.1株下降最为显著,抑制率降至38.8%,B.1.351株降至39.2%(图1B)。
不同暴露史背景的免疫应答差异
抗体浓度的差异
在3个月后,PCR阳性组的抗RBD IgG浓度显著高于其他两组,中位数为27.2 μg/mL,而血清阳性组和血清阴性组分别为8.2 μg/mL和8.7 μg/mL。这一结果表明,曾确诊COVID-19的个体在疫苗接种后产生了更强的体液免疫应答。
中和能力的差异
尽管抗体浓度存在显著差异,但在替代中和试验中,不同暴露史组之间对变异株的中和能力差异并不显著(Wilcoxon秩和检验,p > 0.7)。然而,PCR阳性组在所有变异株上的中和抑制率均略高于其他两组,提示既往感染可能增强疫苗的交叉保护能力。
图表与数据支持
图1:抗体浓度与中和能力变化趋势
图1A展示了抗体浓度在接种过程中的变化,图1B则显示了不同时间点对野生型及变异株的中和抑制率。图1C通过回归模型揭示了第二剂抗体水平与3个月后抗体水平之间的强相关性。图1D进一步展示了不同暴露史组在3个月时对各变异株的中和能力。
| 组别 | 抗体浓度(μg/mL) | 野生型抑制率(%) | P.1抑制率(%) | B.1.351抑制率(%) | B.1.1.7抑制率(%) |
|---|---|---|---|---|---|
| PCR阳性组 | 27.2 | 98.5 | 78.2 | 75.1 | 94.3 |
| 血清阳性组 | 8.2 | 97.1 | 68.5 | 64.2 | 91.0 |
| 血清阴性组 | 8.7 | 97.0 | 67.8 | 63.5 | 90.5 |
研究意义与启示
该研究系统评估了mRNA疫苗接种后抗体应答的持久性及对变异株的交叉中和能力,揭示了以下几个关键发现:
抗体应答在接种后3个月显著下降,提示免疫保护可能随时间减弱;
变异株尤其是P.1和B.1.351株对中和作用更具抵抗力,可能影响疫苗的保护效力;
既往感染史,尤其是有症状的COVID-19感染者,在疫苗接种后产生更强的抗体应答,但无症状感染者的免疫增益有限;
第二剂疫苗后的抗体水平对未来免疫持久性具有预测价值,可作为评估是否需要加强免疫的参考指标。
这些发现为制定加强免疫策略提供了重要依据,尤其在高风险人群和变异株流行地区,可能需要更早或更频繁地进行疫苗加强接种。
方法学优势与局限
该研究采用干血点采样法,具有操作简便、可远程采集的优势,且与血清样本结果高度一致(R = 0.99),保证了数据的可靠性。同时,替代病毒中和试验与真实病毒中和试验结果高度相关(R = 0.93),验证了其在评估中和能力方面的有效性。
然而,研究样本量较小(n=27),且主要为年轻健康人群,可能限制了结果的广泛适用性。此外,研究未评估T细胞免疫应答,而T细胞在清除病毒感染和减轻疾病严重程度方面同样发挥重要作用。未来研究应结合体液与细胞免疫指标,全面评估疫苗保护力。
结语
McDade等人的研究为理解mRNA疫苗免疫应答的动态变化提供了详实的数据支持,强调了抗体水平下降和变异株逃逸的现实挑战。随着病毒持续演化,基于个体暴露史和免疫应答特征制定个性化疫苗接种策略,将成为未来疫情防控的重要方向。该研究不仅为加强免疫提供了科学依据,也为疫苗接种政策的优化和公共卫生决策提供了关键参考。
| 名称 | 货号 | 规格 |
| U-PLEX Proinflam Combo 1 (hu) SECTOR (25 PL) | K15049K-4 | 25PL |
| U-PLEX Proinflam Combo 1 (hu) SECTOR (5 PL) | K15049K-2 | 5PL |
| U-PLEX Proinflam Combo 1 (hu) SECTOR (1 PL) | K15049K-1 | 1PL |