Serum inflammatory profiles in cystic fibrosis mice with and without Bordetella pseudohinzii infection
一、研究背景与意义
囊性纤维化(Cystic Fibrosis, CF)作为一种常染色体隐性遗传病,其致病根源在于囊性纤维化跨膜传导调节因子(Cystic Fibrosis Transmembrane Conductance Regulator, CFTR)蛋白功能异常。在全球范围内,CF 给患者健康带来严重威胁,仅在美国,每 3400 名新生儿中就约有 1 例患病,且是高加索人群中最常见的致死性遗传病。CFTR 基因的突变(其中最常见的是 F508del 突变)导致 CFTR 蛋白功能缺陷,进而对机体多个器官系统产生影响,其中肺部、肠道和内分泌系统受损最为严重。
在肺部,CF 的典型特征是上皮细胞层黏液堆积,这一病理改变为细菌滋生提供了有利环境,引发自发性、进行性感染以及严重的炎症反应。感染与炎症相互作用形成恶性循环,不断损害肺功能,而肺功能下降正是 CF 患者发病和死亡的首要原因。长期以来,研究人员发现即使在未检测到感染的情况下,CF 患者血清、气管细胞和支气管肺泡灌洗液中炎症标志物也存在定量差异,这一现象提示 CFTR 功能缺失本身就可能导致免疫反应失调。然而,在人类研究中,由于难以区分炎症是由长期慢性感染引发,还是 CFTR 功能丧失导致的固有变化,使得探究 CFTR 缺失与全身性炎症之间的关系面临巨大挑战。
小鼠模型的出现为解决这一难题提供了重要途径。F508del CF 小鼠作为研究 CF 相关性肺部疾病的重要工具,已被证实即使在无感染状态下,其肺功能(如肺顺应性降低、弹性增加)也显著低于野生型 C57BL6 小鼠。此前针对 CF 小鼠的研究多聚焦于支气管肺泡灌洗液(BALF)中的炎症因子,对于血清中炎症因子水平与 BALF 中变化的相关性研究相对较少。此外,CF 小鼠虽不易发生自发性铜绿假单胞菌感染,但易发生自发性假性 Hinzii 博德特氏菌(Bordetella pseudohinzii)肺部感染,且这种感染与 CFTR 缺失直接相关,CF 小鼠对该病原体的易感性更高,清除感染的能力更弱。然而,关于这种自发性感染引发的炎症反应研究却十分有限。
基于上述研究现状,本研究通过检测 F508del CF 小鼠和非 CF 小鼠血清中多种细胞因子和趋化因子的水平,深入探究 CFTR 缺失对血清特异性炎症标志物的影响,分析自发性假性 Hinzii 博德特氏菌感染以及人工诱导感染对 CF 小鼠炎症谱的作用,旨在明确 CFTR 功能与全身性炎症的关系,为 CF 炎症机制研究及临床诊断治疗提供重要实验依据。
二、材料与方法
(一)实验动物模型
本研究采用了一种已被充分描述的囊性纤维化同基因小鼠模型,该小鼠为 CFTR 基因 F508del 突变纯合子(Cftrtm1kth)。为减少遗传漂变,这些小鼠在 C57BL/6J 背景下培育,且每 5 代进行一次回交。因此,实验中选用野生型 C57BL/6J 小鼠作为非 CF 对照组。
实验所用小鼠均为成年小鼠(至少 8 周龄),雌雄各占一半。小鼠可自由获取饲料(Harlan Teklad 7960;Harlan Teklad Global Diets,美国威斯康星州麦迪逊市)和含有渗透性泻药 Colyte(Schwarz Pharma,美国威斯康星州密尔沃基市)的无菌水。在整个实验过程中,小鼠饲养环境保持 12 小时光照、12 小时黑暗的昼夜节律,平均环境温度维持在 22°C。
所有实验方法均严格遵循相关指南和规定,凯斯西储大学机构动物护理和使用委员会批准了本研究使用的实验方案。所有小鼠实验均按照 ARRIVE 指南进行报告,并符合美国兽医协会(AVMA)动物安乐死指南(2020 年)。
(二)血液提取与血清分离
小鼠处死后,采用血清分离微量离心管(BD)收集全血,随后以 10000 转 / 分钟的转速离心 5 分钟。离心完成后,将血清吸入无菌微量离心管中,并立即在 -80°C 条件下储存,以备后续检测分析。
(三)假性 Hinzii 博德特氏菌酶联免疫吸附试验(ELISA)
将小鼠血清按 1:50 的比例稀释后,一式两份加入预先包被有小鼠 Hinzii 博德特氏菌抗原的孔中(XpressBio,货号 595-470C),根据制造商说明在 37°C 下孵育 30 分钟。孵育结束后,清洗孔板,加入过氧化物酶偶联物在 37°C 下孵育 45 分钟,再加入 ABTS 底物孵育 30 分钟,最后使用吸光度板读数仪在 405nm 波长下读取吸光度值。
若一式两份样本的平均吸光度值减去阴性抗原对照的吸光度值大于 0.100,则判定结果为阳性。需要注意的是,制造商协议规定吸光度值大于 0.300 时孔板判定为阳性,但实验室研究证据表明,通过体积描记法和 BAL 培养验证为假性 Hinzii 博德特氏菌阳性的小鼠,在较低的吸光度阈值(0.100)下通过 ELISA 判定也为阳性,且仍能与 ELISA 阴性结果区分开来。
(四)Meso 尺度发现(MSD)多斑点小鼠炎症面板检测系统
按照制造商要求,将细胞因子标准品和小鼠血清的两倍稀释液一式两份加入预先包被的 V-plex 孔中(MSD 小鼠细胞因子 29 重检测试剂盒、MSD 小鼠促炎面板 1,货号分别为 K15267D-1、K15048D-1),在室温下振荡孵育 2 小时。之后清洗每个孔板,吸干水分,加入检测抗体孵育 2 小时。孵育结束后,加入读数缓冲液,立即使用 Meso Scale Discovery QuickPlex SQ 120 读取每个孔板的数据,并使用配套软件进行数据分析。29 项独立检测总共在 3 个孔板上进行多重检测。
(五)假性 Hinzii 博德特氏菌感染处理
实验中对两组不同小鼠群体进行了感染情况研究。第一组为在生命周期中某一时刻发生自然、自发性感染的 CF 小鼠,这些小鼠在饲养环境中自然生活,处死后检测假性 Hinzii 博德特氏菌抗体呈阳性。需要说明的是,基于 ELISA 的检测方法无法指示是否为活动性感染,仅能确认这些小鼠曾接触过该病原体并产生了免疫反应。
第二组小鼠在人工感染活性假性 Hinzii 博德特氏菌菌株前,经检测确认未感染该菌。通过测定吸光度值绘制假性 Hinzii 博德特氏菌培养物的生长曲线,以确定该病原体的对数生长期。当培养物达到对数生长期时,获取接种物以确保病原体的活性。使用异氟烷麻醉小鼠后,通过鼻腔给予 5×10^6 剂量的假性 Hinzii 博德特氏菌。分别在感染后 48 小时和 2 周从小鼠体内提取全血,立即放入血清分离微量离心管中,用于后续分析。
(六)统计学分析
采用单因素方差分析(ANOVA)进行假设检验,显著性水平设定为 p<0.05。由于本研究具有探索性,且采用多重检测策略需要进行大量比较,因此未对初始 p 值进行调整。相反,在每个独立的方差分析之后,采用保守的事后 Tukey 诚实显著性差异检验来确定每组内的显著性,减少单个检验中的误差。尽管这种方法可能会因多重比较而增加 I 类错误,但能清晰地显示多组间的显著性方向。
对于超出数据集上下限(超出第一四分位数或第三四分位数 1.5 倍四分位距)的极端异常值,予以剔除,不纳入方差分析。分别对雄性和雌性小鼠的实验结果进行分析,发现其变化方向和幅度均无显著差异,因此将数据合并以提高统计效力。
三、实验结果
(一)囊性纤维化小鼠血清特异性炎症标志物
为探究 F508del 小鼠血清特异性炎症谱,本研究采用高通量、多重比色系统检测了 29 种不同细胞因子。在检测的 29 种细胞因子中,有 22 种获得了有效数据记录,其余 7 种与标准曲线相比低于可检测范围,本研究仅呈现可检测到浓度的细胞因子。这些检测到的细胞因子被分为三类:促炎细胞因子、抗炎细胞因子和一般炎症标志物。
1. 非囊性纤维化与囊性纤维化小鼠促炎标志物对比
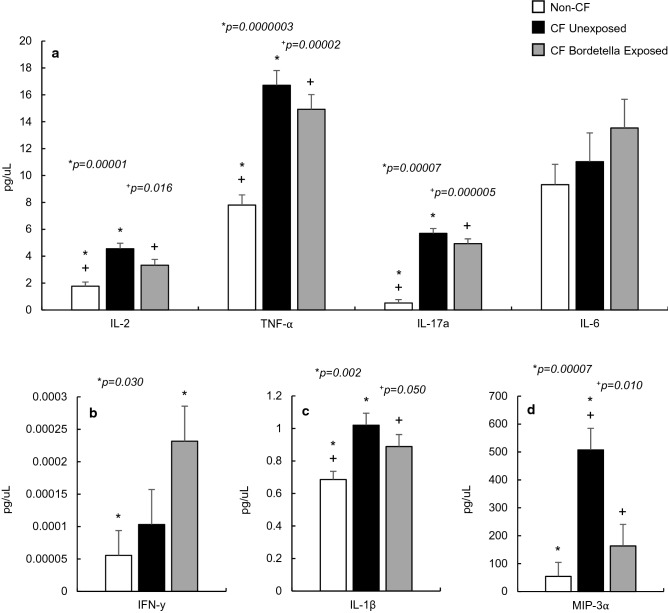
在 20 只 CF 小鼠和 20 只年龄匹配的非 CF 小鼠中,检测了血清中促炎标志物 IL-1β、IL-2、TNF-α、IL-17a、IL-6、IFN-γ 和 MIP-3a 的水平(图 1)。在这 7 种分析物中,除 IFN-γ 和 IL-6 外,CF 小鼠血清中其余促炎标志物水平均显著升高(p<0.050,图 1a-d)。
此前针对 CFTR 缺陷小鼠的研究发现,其支气管肺泡灌洗液(BALF)中的促炎标志物也有类似升高,尤其是与细胞介导免疫、巨噬细胞存在及活性直接相关的 Th1 细胞分泌的细胞因子,本研究在 F508del 小鼠血清中观察到的 IL-2 和 TNF-α 水平升高(图 1a)与该研究结果一致。值得注意的是,此前研究中发现的 BALF 中 IL-6 水平升高,在本研究的血清检测中未观察到(图 1a)。此外,本研究还发现 CF 小鼠血清中 MIP-3α 水平显著升高,增幅接近 7 倍(p=0.00007,图 1d)。
2. 非囊性纤维化与囊性纤维化小鼠抗炎标志物对比
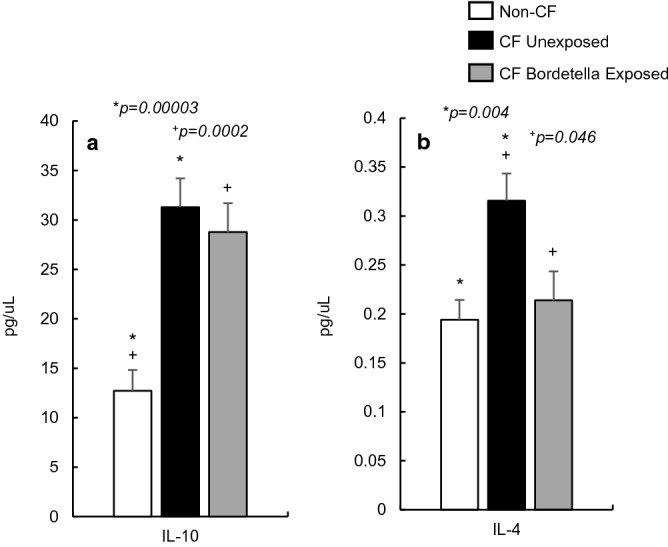
检测了 CF 小鼠和非 CF 小鼠血清中两种主要的抗炎细胞因子,即 Th1 来源的 IL-10 和 Th2 来源的 IL-4(图 2)。此前针对 CF 小鼠肺部的研究报道称抗炎标志物水平降低,但本研究发现,在不考虑感染因素的情况下,CF 小鼠血清中 IL-10 水平显著升高(p<0.05)(图 2a)。
对 IL-4 的检测也得到了类似结果,IL-4 作为一种正反馈细胞因子,可下调 IFN-γ 和 TNF-α 的水平,并在抗原反应中发挥重要作用。与非 CF 对照组相比,CF 小鼠血清中 IL-4 浓度显著升高(p<0.05)(图 2b),这与 CF 小鼠血清中效应促炎细胞因子水平升高的情况相符。
3. 非囊性纤维化与囊性纤维化小鼠一般炎症标志物对比
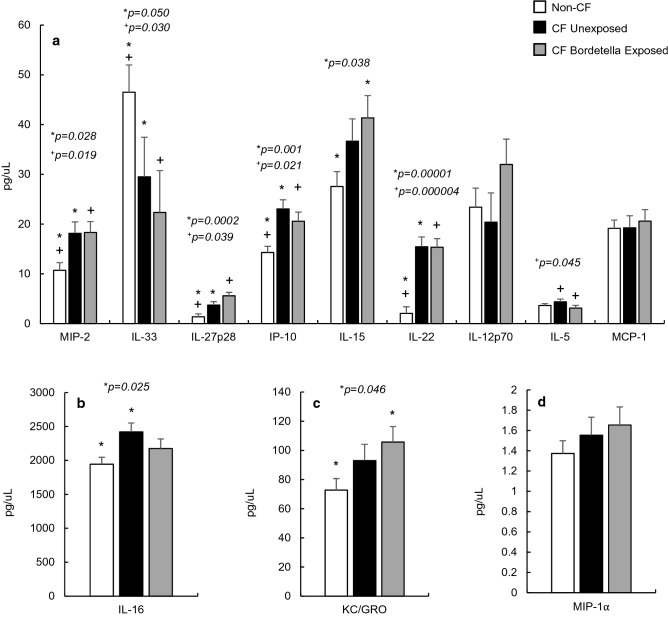
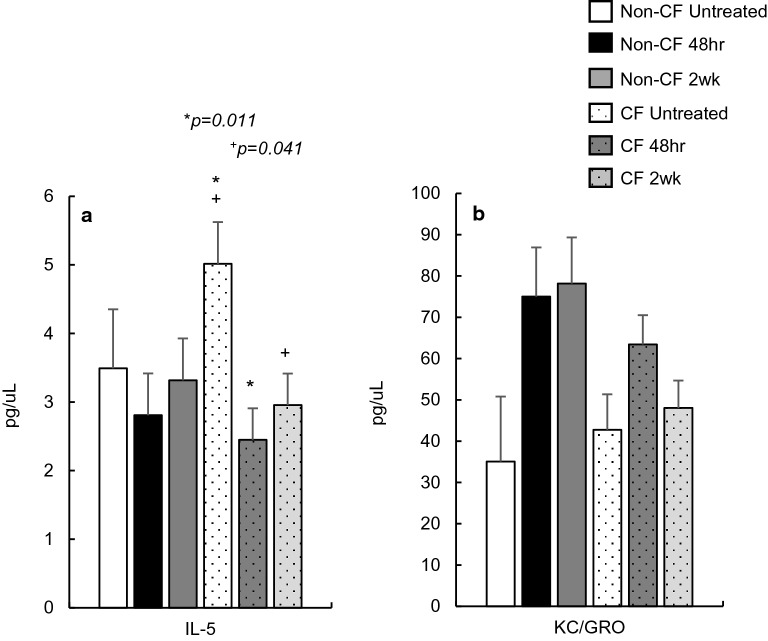
最后一组分析物既不属于促炎标志物,也不属于抗炎标志物,但其性质通常具有多效性,且会根据炎症事件的具体情况受到更特异性的调控。这些标志物包括 C-X-C 趋化因子 MIP-1α、MIP-2、IP-10、角质形成细胞趋化因子 / 生长调节癌基因 KC/GRO、单核细胞趋化蛋白 MCP-1,以及白细胞介素家族中的 IL-5、IL-12p70、IL-15、IL-16、IL-22、IL-27p28 和 IL-33(图 3a-d)。
在 12 种一般炎症标志物中,CF 小鼠和非 CF 小鼠血清浓度有 6 种存在显著差异,其中 MIP-2、IL-27p28、IP-10、IL-22 和 IL-16 与非 CF 对照组相比显著升高(p<0.050,图 3a,b)。值得注意的是,IL-33(图 3a)是所有检测的炎症标志物中唯一在 CF 小鼠血清中水平显著降低的标志物(p=0.050)。
(二)自发性感染对炎症标志物的影响
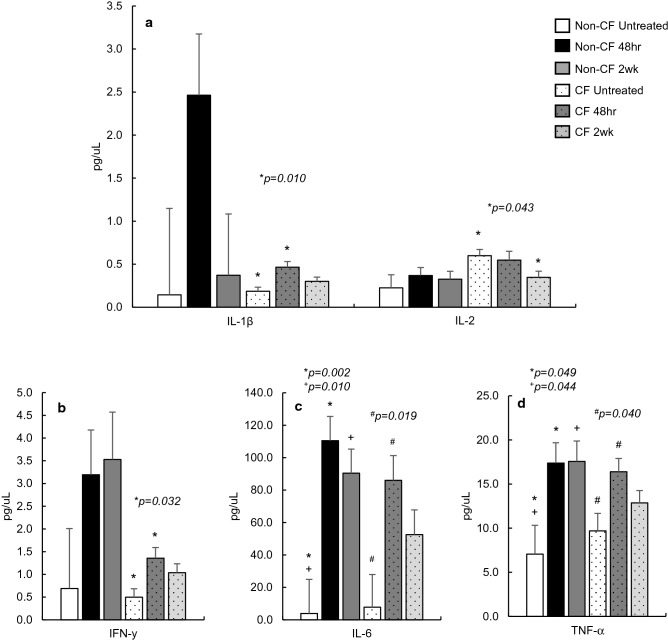
研究表明,在实验设施饲养的 CF 小鼠中,约 30% 会在生命周期中发生自发性假性 Hinzii 博德特氏菌感染,而在混合群体中的非 CF 小鼠中,这一比例仅为 2%。此外,通过体积描记法和支气管肺泡灌洗液(BAL)培养证实,CF 小鼠清除感染困难,需要 8-12 周甚至更长时间,而非 CF 小鼠仅需 1-3 周即可清除感染。为确定自发性肺部感染对血清炎症标志物的影响,本研究通过 ELISA 检测,将一部分曾接触过该病原体(假性 Hinzii 博德特氏菌抗体检测呈阳性)的 CF 小鼠与未感染的 CF 小鼠进行了对比分析(表 1)。
表 1. 假性 Hinzii 博德特氏菌 ELISA 检测结果
| 名称 | 货号 | 规格 |
| U-PLEX Proinflam Combo 1 (hu) SECTOR (25 PL) | K15049K-4 | 25PL |
| U-PLEX Proinflam Combo 1 (hu) SECTOR (5 PL) | K15049K-2 | 5PL |
| U-PLEX Proinflam Combo 1 (hu) SECTOR (1 PL) | K15049K-1 | 1PL |