Links between objective sleep and sleep variability measures and inflammatory markers in adults with bipolar disorder
研究背景与意义
双相障碍(Bipolar Disorder, BD)是一种严重的慢性情绪障碍,其特征为情绪的极端波动,包括躁狂和抑郁发作。已有研究表明,BD患者不仅面临较高的自杀风险和功能障碍,还表现出更高的早发躯体疾病发病率和死亡率,尤其是心血管疾病、代谢综合征和糖尿病等。这些现象提示BD患者可能存在“生物老化加速”的现象,而炎症反应被认为是连接精神疾病与躯体疾病的重要机制之一。
睡眠障碍是BD的核心症状之一,不仅在急性发作期表现明显,在缓解期也普遍存在。已有研究指出,睡眠剥夺和睡眠质量下降可激活外周炎症反应,表现为IL-6、CRP、TNF-α等炎症因子的升高。然而,关于BD患者中客观睡眠指标与其炎症水平之间的关系,尤其是睡眠变异性(如睡眠时长波动、入睡/起床时间的不规律)与炎症标志物之间的关联,尚缺乏系统研究。
本研究由加州大学圣地亚哥分校主导,旨在探讨BD成人中客观睡眠指标及其变异性与炎症标志物(IL-6、CRP、TNF-α)之间的关系,并与非精神病对照组(NC)进行比较。研究采用腕式活动记录仪(actigraphy)获取连续7晚的客观睡眠数据,结合三次血液采样测定炎症因子水平,通过线性与时间滞后模型分析睡眠与炎症之间的横断面与短期关联。
研究设计与方法
研究对象与样本特征
研究纳入50名BD患者与73名年龄、性别匹配的非精神病对照者(NC),年龄范围为26–65岁。所有参与者均为英语母语者,居住于圣地亚哥地区。BD的诊断依据DSM-IV-TR结构化临床访谈(SCID)确认,排除标准包括:其他轴I精神障碍、急性疾病、妊娠、近期疫苗接种、神经系统疾病、癌症治疗史及严重躯体疾病等。
两组在年龄、性别、种族分布上无显著差异,但BD组受教育年限较低,抑郁症状更严重,IL-6与TNF-α水平显著高于NC组(p < 0.05),CRP水平虽有升高趋势但未达统计学显著(p = 0.20)。此外,BD组主观睡眠质量更差(PSQI评分更高),使用助眠药物的比例也显著高于NC组。
睡眠评估方法
主观睡眠质量采用匹兹堡睡眠质量指数(PSQI)评估,涵盖入睡时间、睡眠效率、睡眠障碍、日间功能障碍等维度。客观睡眠指标则通过腕式三轴加速度计(Actisleep-BT)连续记录7天,获取以下指标:
总睡眠时间(TST):每晚实际睡眠分钟数;
睡眠效率(PS):睡眠时间占卧床时间的百分比;
入睡时间(Bed Time)与起床时间(Wake Time):基于活动记录与睡眠日志校正。
睡眠变异性通过**个体内标准差(iSD)**衡量,反映个体在7天内各睡眠指标的波动程度。此外,研究还引入了“睡眠异质性(atypicality)”指标,衡量某一晚睡眠指标与个体平均水平的偏离程度,用于时间滞后分析。
炎症标志物测定
在为期两周的评估期内,所有参与者在三个不同时间点采集血液样本,测定IL-6、CRP与TNF-α水平,取三次测量平均值作为个体炎症水平。采用Meso Scale Discovery(MSD)电化学发光法进行测定,所有样本双重复检测,批内变异系数<10%,批间<5%。
研究结果
睡眠变异性与IL-6水平的关系
线性回归模型显示,在所有参与者中,TST的个体内标准差(iSD)与IL-6水平显著正相关(β = 0.30, p = 0.04, ηp² = 0.042),即睡眠时长波动越大,IL-6水平越高。该关系在BD组与NC组中均存在,且未表现出显著的组间交互作用(p = 0.65),提示该关联具有跨诊断一致性。
此外,前一晚TST的异质性(atypicality)可显著预测次日晨IL-6水平(β < 0.001, p = 0.05, ηp² = 0.04),表明即使是短期的睡眠异常,也可能引发急性炎症反应。
睡眠效率与炎症标志物的关系
睡眠效率(PS)的平均水平与IL-6(β = -1.65, p = 0.05, ηp² = 0.039)和CRP(β = -3.77, p = 0.05, ηp² = 0.039)均呈负相关,即睡眠效率越低,炎症水平越高。该结果支持睡眠结构完整性在调节炎症反应中的重要作用。
然而,前一晚PS的水平并未显著预测次日CRP或IL-6水平,提示睡眠效率可能更多地反映慢性睡眠质量问题,而非短期炎症反应的触发因素。
其他睡眠指标与炎症的关系
入睡时间与起床时间的变异性(iSD)与炎症标志物之间未发现显著关联。主观睡眠质量(PSQI评分)亦未与任何炎症指标显著相关,提示主观睡眠感受与客观生理反应之间可能存在脱节。
TNF-α水平与睡眠指标之间未发现显著关联,但其基线水平受年龄与诊断状态显著影响(BD组与年龄较大者TNF-α水平更高),提示其可能更多受慢性病理状态驱动。
图表与数据展示
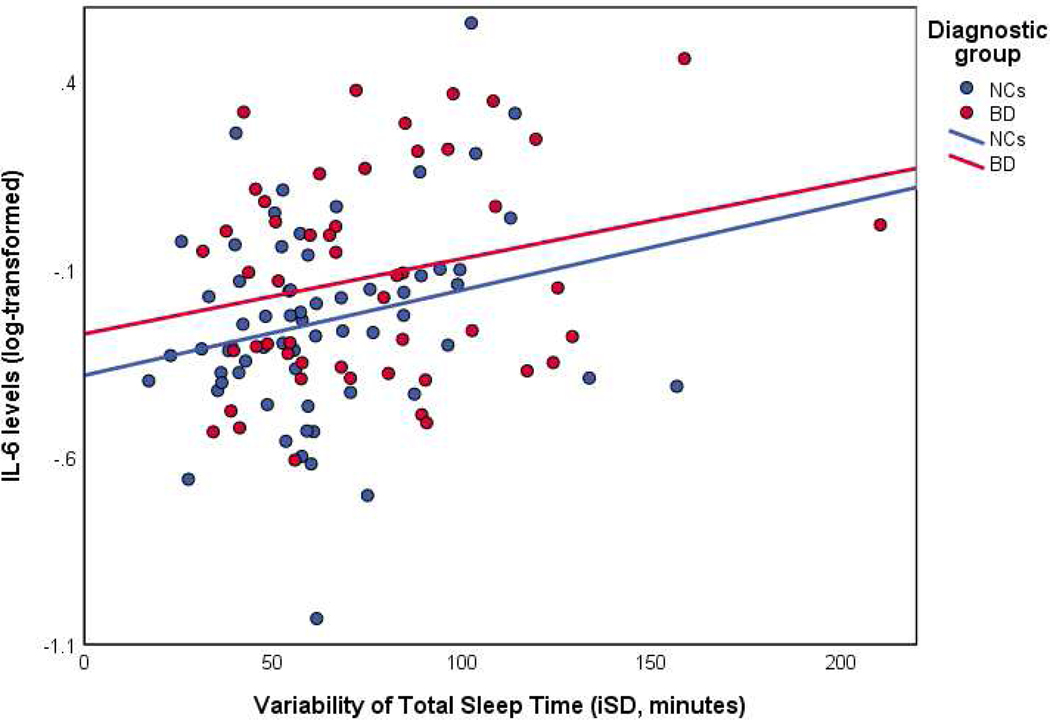
图1:TST变异性与IL-6水平散点图
图中显示,无论是BD组还是NC组,TST-iSD与IL-6之间均呈正相关趋势,且两组斜率相近,说明该关联不受诊断状态影响。
表1:睡眠指标与IL-6、CRP、TNF-α的回归结果摘要
| 睡眠指标 | IL-6(β) | CRP(β) | TNF-α(β) |
|---|---|---|---|
| TST-iSD | 0.30* | 0.15 | 0.07 |
| PS-Mean | -1.65* | -3.77* | -0.13 |
| PS-iSD | 0.18 | 0.12 | 0.04 |
| 睡眠异质性(TST) | <0.001* | <0.001* | — |
*注:表示p < 0.05,模型已控制年龄、性别、诊断组、助眠药物使用等混杂变量。
讨论与机制解析
睡眠变异性与慢性炎症
本研究首次在BD人群中系统探讨了睡眠变异性与炎症标志物之间的关系,发现TST波动是IL-6升高的独立预测因子。该结果与一般人群中的研究发现一致,如Okun等(2011)在老年人中亦发现睡眠时长波动与IL-6升高相关。睡眠节律的不规律可能通过扰乱昼夜节律系统,激活下丘脑-垂体-肾上腺轴(HPA轴)与交感神经系统,进而促进炎症因子的释放。
睡眠效率与炎症反应
睡眠效率低可能反映夜间觉醒频繁、浅睡比例增加等结构性问题,这种状态与慢性低度炎症状态密切相关。已有研究表明,睡眠片段化可激活单核细胞与巨噬细胞,促进IL-6与CRP的合成,进而参与动脉粥样硬化、胰岛素抵抗等病理过程。
主观与客观睡眠的脱节
本研究未发现主观睡眠质量与炎症标志物之间的显著关联,提示个体对睡眠的感知可能并不准确,或主观评估工具(如PSQI)与生理反应之间存在时间尺度错配。例如,PSQI评估的是过去一个月的总体睡眠状况,而炎症标志物可能对前一晚的睡眠变化更为敏感。
研究局限与未来方向
尽管本研究在方法上具有多项优势,如客观睡眠测量、多时间点炎症评估、控制多种混杂变量等,但仍存在以下局限:
横断面设计:无法确定睡眠与炎症之间的因果关系;
缺乏多导睡眠监测(PSG):无法分析睡眠结构(如REM/NREM比例);
样本特征限制:BD组为门诊稳定期患者,结果未必适用于急性期或难治性群体;
药物影响未完全控制:虽控制助眠药物使用,但未对具体药物种类与剂量进行细致分析;
未纳入BMI与肥胖指标:肥胖本身即可影响睡眠与炎症,未来研究应进一步纳入该变量。
未来研究可采用纵向测量爆发设计(measurement burst design),结合生态瞬时评估(EMA)与多模态睡眠监测,进一步阐明睡眠-炎症关系的动态变化机制。此外,干预研究可探索通过**睡眠节律调节(如光照疗法、认知行为疗法)**是否可有效降低BD患者的炎症水平,从而改善其躯体健康状况。
结语
本研究提供了强有力的证据,表明客观睡眠指标及其变异性与炎症标志物之间存在稳定关联,该关联在BD患者与非精神病对照者中均成立,提示睡眠问题可能是精神疾病与躯体疾病之间的重要桥梁。睡眠不仅是精神症状的晴雨表,更可能是干预炎症、延缓衰老、改善预后的关键靶点。对于BD患者而言,改善睡眠节律、提高睡眠效率、减少睡眠波动,或许能成为未来综合治疗策略中不可或缺的一环。
| 名称 | 货号 | 规格 |
| U-PLEX Proinflam Combo 1 (hu) SECTOR (25 PL) | K15049K-4 | 25PL |
| U-PLEX Proinflam Combo 1 (hu) SECTOR (5 PL) | K15049K-2 | 5PL |
| U-PLEX Proinflam Combo 1 (hu) SECTOR (1 PL) | K15049K-1 | 1PL |