Drugging the NLRP3 inflammasome: from signalling mechanisms to therapeutic targets.

慢性炎症相关疾病已然成为全球性的重大健康难题,给世界各国的医疗体系和民众健康带来了沉重的负担。炎症小体之中,NACHT、LRR 和 PYD 结构域蛋白 3(NLRP3)炎症小体尤为突出,它在机体应对感染与组织损伤所引发的炎症反应过程中占据核心地位,并且已经成为多种风湿性疾病、代谢性疾病以及神经退行性疾病的关键调控因素。类似于其他炎症小体传感器,NLRP3 能够构建胞质先天免疫复合物,促使半胱氨酸蛋白酶 caspase - 1 被激活,随后该酶对 gasdermin D(GSDMD)进行切割,最终诱发细胞焦亡,这是一种受到精细调控的裂解性细胞死亡形式。细胞焦亡具有极为强烈的炎症特性,其产生原因一方面在于炎症小体依赖性细胞因子白细胞介素 - 1β(IL - 1β)和白细胞介素 - 18(IL - 18)向细胞外释放,另一方面则是由于大量其他危险信号以及细胞内抗原的存在。
解析人类炎症小体
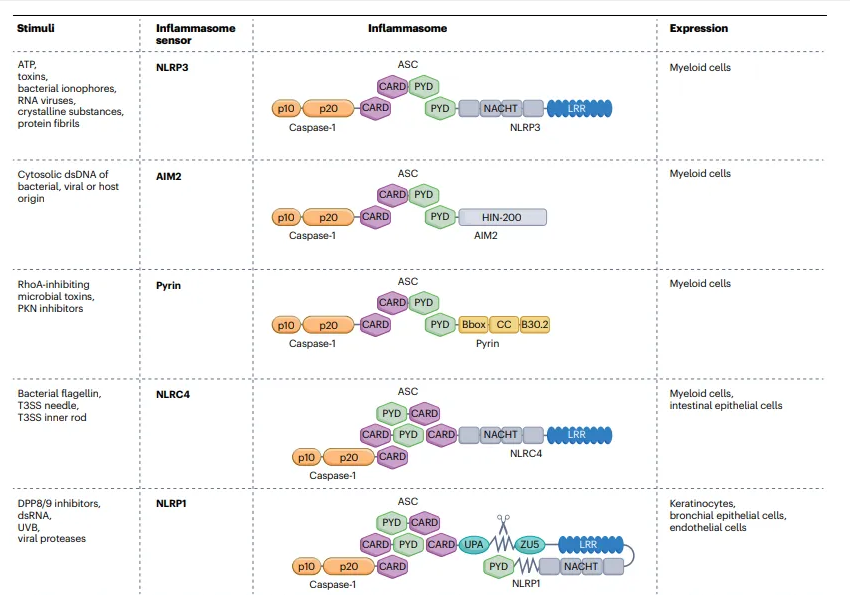
不同的刺激能够激活各异的炎症小体传感器。对于包含 pyrin 结构域(PYD)的炎症小体(即不存在于黑色素瘤 2(AIM2)和 pyrin 中的 NACHT、LRR 和含有 PYD 结构域的蛋白 3(NLRP3))以及含有 CARD 的炎症小体(NLRC4 和 NLRP1)而言,其激活过程借助同源的 PYD - PYD 和 CARD - CARD 相互作用,来推动凋亡相关的含有 CARD(ASC)的斑点样蛋白的聚集以及胱天蛋白酶 - 1 的活化。而 CARD8 炎症小体则有所不同,它能够避开 ASC,通过 CARD - CARD 相互作用直接激活胱天蛋白酶 - 1。
NLRP3 炎症小体激活的分子驱动机制剖析
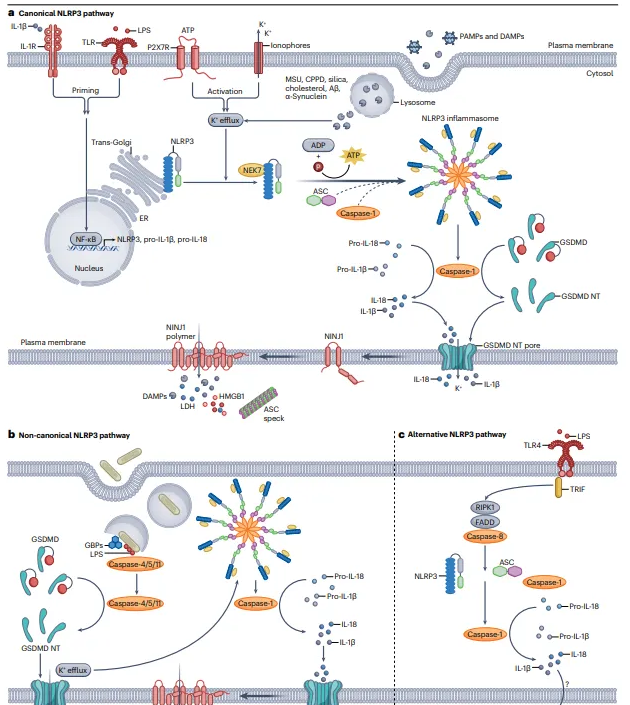
NACHT、LRR 和 PYD 结构域含蛋白 3(NLRP3)的激活主要经由三条途径得以实现。其一,典型的 NLRP3 途径涵盖启动与激活两个步骤。在启动阶段,诸如白细胞介素 - 1 受体(IL - 1R)等刺激细胞因子受体以及 Toll 样受体 4(TLR4)等模式识别受体受到刺激后,会致使核因子 - κB(NF - κB)介导 NLRP3、白细胞介素 - 1β 前体(pro - IL - 1β)以及白细胞介素 - 18 前体(pro - IL - 18)的转录水平上调。而在 NLRP3 激活环节,像细菌离子载体、RNA 病毒等病原体相关分子模式,ATP 等损伤相关分子模式,尿酸单钠(MSU)、焦磷酸钙二水合物(CPPD)等医学相关晶体,还有胆固醇以及 β - 淀粉样蛋白(Aβ)、α - 突触核蛋白等蛋白原纤维,均被视作可推动非活性 NLRP3 向诸如分散的反式高尔基体网络等亚细胞细胞器发生易位的因素。钾离子外流被认定为 NLRP3 在这些亚细胞位置所感知的常见上游机制,不过 NLRP3 也可在不依赖钾离子外流的情况下被激活。一旦接收到激活信号,NLRP3 便会与 NEK7 形成复合物,并募集含有 CARD(ASC)的凋亡相关斑点样蛋白以及胱天蛋白酶 - 1 前体,进而组装成 NLRP3 炎症小体,最终激活胱天蛋白酶 1。活化的胱天蛋白酶 1 会将 pro - IL - 1β 和 pro - IL - 18 切割为成熟形式,同时切割 gasdermin D(GSDMD),促使 GSDMD N - 末端区(GSDMD - NT)在质膜上形成孔洞,使得 IL - 1β、IL - 18 以及离子通量得以通过孔洞释放。随后,GSDMD - NT 孔洞的形成会诱导神经损伤诱导的蛋白 1(NINJ1)驱动质膜破裂,造成大量损伤相关分子模式(DAMP)释放到细胞外空间,包括高迁移率族盒 1(HMGB1)、乳酸脱氢酶(LDH)以及 ASC 斑点等。其二,在非经典途径中,鸟苷酸结合蛋白(GBPs)能够检测入侵细胞的革兰氏阴性菌的膜结合液泡,该蛋白可协调胞浆脂多糖(LPS)与胱天蛋白酶 4/5/11 相接触,从而诱导胱天蛋白酶自我激活。活化的半胱氨酸天冬氨酸蛋白酶 4/5/11 会切割 GSDMD,进而诱发细胞焦亡并通过降低细胞内钾离子水平来激活 NLRP3 炎症小体。其三,在替代性 NLRP3 途径中,TLR4 受到刺激后,会通过涉及受体相互作用蛋白激酶 1(RIPK1)、Fas 相关死亡结构域蛋白(FADD)以及胱天蛋白酶 - 8 的一种尚未完全明晰的机制,在人单核细胞中激活 TIR 结构域含衔接子诱导干扰素 β(TRIF)衔接子下游的 NLRP3。经由该途径激活的 NLRP3 随后会通过未知机制参与胱天蛋白酶 - 1 介导的 IL - 1β 分泌,此过程独立于 ASC 斑点组装,并且不会诱导焦亡。
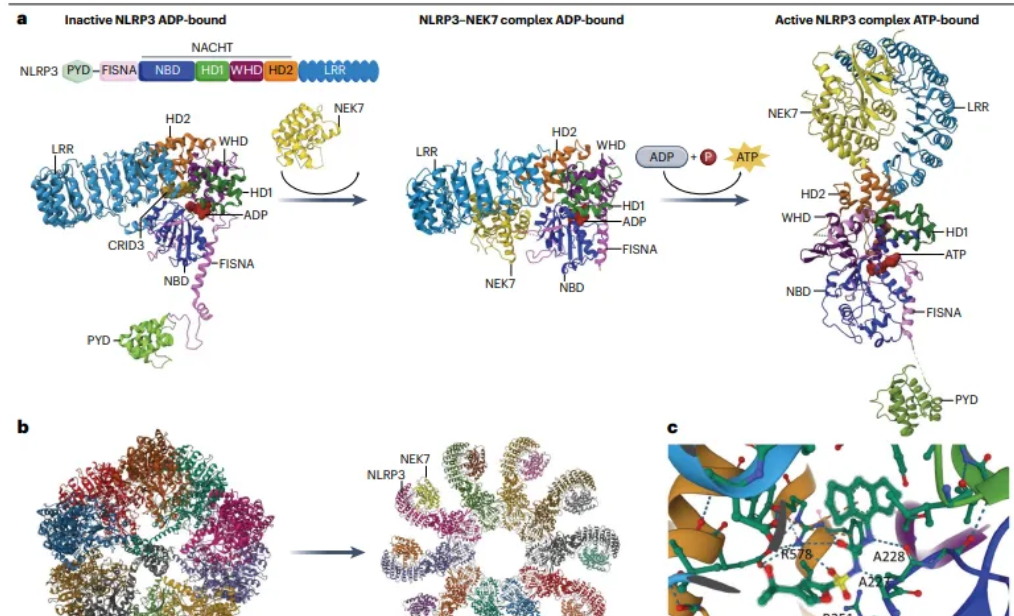
CRID3的结合口袋和NLRP3炎症小体激活的模型
| 名称 | 货号 | 规格 |
| NLRP3 (D4D8T) Rabbit mAb | 15101S | 100ul |
| NLRP3 (D2P5E) Rabbit mAb | 13158T | 20μl |
| Rabbit anti-NLRP3 Polyclonal Antibody | abs151715-50ul | 50ul |







