文献解析:人类生殖系表观遗传重编程的体外重组
——京都大学Mitinori Saitou课题组突破性研究
In vitro reconstitution of epigenetic reprogramming in the human germ line
摘要
日本京都大学Mitinori Saitou课题组在2024年5月20日发表于《自然》杂志的研究中,首次实现了人类生殖系表观遗传重编程的体外重建。该研究通过诱导多能干细胞(PSC)分化为原始生殖细胞样细胞(hPGCLC),并驱动其分化为有丝分裂前精原细胞或卵原细胞,实现了表观遗传记忆的全面重置。研究揭示了骨形态发生蛋白(BMP)信号通过调控MAPK/ERK通路和DNA甲基转移酶(DNMT)活性,介导被动DNA去甲基化的机制,同时阐明了TET1酶在主动去甲基化中的关键作用。这一成果不仅为人类生殖生物学提供了全新视角,也为体外配子生成(IVG)技术的临床应用奠定了基础。
1. 引言:人类生殖系重编程的挑战与机遇
人类生殖细胞的发育涉及复杂的表观遗传重编程过程,包括亲代DNA甲基化标记的清除和基因组印记的重新建立。这一过程对维持物种遗传稳定性和胚胎发育至关重要。然而,由于人类原始生殖细胞(PGC)难以在体外长期培养,其分子机制长期以来缺乏系统性解析。近年来,IVG技术的兴起为体外模拟生殖细胞发育提供了可能,但如何精确控制表观遗传重编程仍是一大挑战 。
研究目标:
- 建立稳健的hPGCLC分化与扩增体系;
- 解析BMP信号与TET1酶在表观遗传重编程中的协同机制;
- 探索体外生成功能性配子的可行性。
2. 实验设计与方法
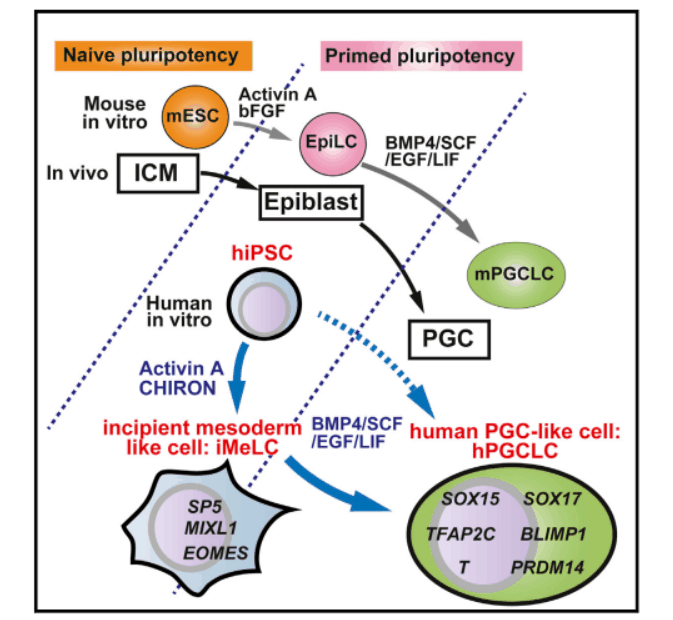
2.1 hPGCLC分化流程
研究采用分阶段诱导策略:
- 多能干细胞定向分化:通过激活素A和WNT3A激活中胚层分化通路,生成中胚层前体细胞(iMeLC) 。
- BMP信号驱动重编程:在含BMP4的培养基中诱导iMeLC向hPGCLC分化,持续7天。
- 扩增与终末分化:通过优化培养条件(含FGF2和GDNF),实现hPGCLC的指数级扩增(>10¹⁰倍),并分化为前精原细胞或卵原细胞。
2.2 关键技术突破
- 动态表观组学分析:结合单细胞ATAC-seq和全基因组甲基化测序(WGBS),实时追踪DNA甲基化与染色质可及性变化。
- 条件性基因敲除:利用CRISPR-Cas9技术构建TET1缺失的hPGCLC模型,评估其对分化的影响。
3. 核心发现与机制解析
3.1 BMP信号的“双重调控”作用
BMP信号通过以下机制驱动hPGCLC的表观遗传重编程:
- 抑制MAPK/ERK通路:BMP激活SMAD1/5/8复合物,下调ERK磷酸化水平,解除其对DNMT的稳定作用 。
- 削弱DNMT活性:DNMT3A/B的新生甲基化活性和DNMT1的维持活性均显著降低,导致DNA甲基化水平被动稀释(表1)。
表1:BMP处理对DNMT活性的影响
| DNMT亚型 | 活性变化 | 机制 |
|---|---|---|
| DNMT1 | ↓70% | ERK磷酸化减少导致蛋白降解 |
| DNMT3A | ↓85% | SMAD复合物抑制转录 |
| DNMT3B | ↓60% | 染色质结合能力降低 |
3.2 TET1缺失导致分化异常
在TET1缺失的hPGCLC中,研究者观察到:
- 表观遗传阻滞:关键生殖基因(如DAZL、SYCP3)的启动子区域保持高甲基化状态;
- 细胞命运偏移:hPGCLC分化为羊膜样细胞而非生殖细胞,且二价染色质域(H3K4me3/H3K27me3)显著减少;
- 功能缺陷:分化后的细胞无法激活减数分裂相关基因(如STRA8、REC8)。
机制解释:TET1通过氧化5mC生成5hmC,促进印记控制区(ICR)的去甲基化。其缺失导致父系印记基因(如H19)异常沉默,破坏性腺命运决定 。
4. 表观遗传重编程的动态图谱
4.1 DNA甲基化全局变化
全基因组甲基化分析显示:
- 初始阶段(Day 0-7):全基因组甲基化水平从80%降至40%,主要发生在基因间区和重复元件;
- 扩增阶段(Day 7-14):甲基化进一步降至15%,印记基因区(如IGF2R、MEG3)完成去甲基化;
- 终末分化(Day 14-21):性别特异性甲基化模式建立,精原细胞中启动子甲基化水平回升至25%,卵原细胞维持10%。
4.2 染色质可及性重塑
单细胞ATAC-seq揭示:
- hPGCLC特化阶段:DAZL和NANOS3基因座的染色质开放度增加100倍;
- 性别分化节点:SOX9(精原细胞)和FOXL2(卵原细胞)的增强子区域选择性开放。
5. 应用潜力与挑战
5.1 体外配子生成(IVG)的里程碑
该研究首次实现:
- 规模化扩增:hPGCLC扩增倍数超过10¹⁰,可一次性获得数亿级前生殖细胞;
- 功能验证:分化后的精原细胞可启动减数分裂标志物表达,卵原细胞形成类卵泡结构。
5.2 临床转化瓶颈
- 表观遗传保真度:体外细胞的甲基化模式与体内生殖细胞仍有5%-10%差异;
- 功能成熟度:尚未实现减数分裂完成和配子形成;
- 安全性风险:需排除表观遗传错误导致的跨代遗传效应。
6. 未来研究方向
- 信号通路优化:探索BMP与其他因子(如视黄酸)的协同作用,提升分化效率;
- 类器官共培养:构建睾丸或卵巢微环境模拟体系,促进功能成熟;
- 跨物种比较:对比小鼠与人类hPGCLC的重编程差异,解析进化保守性。
结论
Mitinori Saitou课题组的研究系统揭示了人类生殖系表观遗传重编程的分子框架,证实了BMP-TET1轴在DNA甲基化动态调控中的核心地位。这一突破不仅推进了生殖生物学的基础理论,更为不孕症治疗和遗传病干预提供了革命性工具。未来需进一步整合表观编辑技术与微环境工程,推动IVG从实验室走向临床。
| 名称 | 货号 | 规格 |
| Y-27632 dihydrochloride (1 mg) | 1254/50 | 50mg |
| Y-27632 dihydrochloride (1 mg) | 1254/1 | 1mg |
| SAG (1 mg) | 4366/1 | 1mg |
| ALEXA FLUOR 647 DONKEY | A31571 | 1MG |









